山東賦悅科技eCTD哪家好 和諧共贏 賦悅科技供應(yīng)
發(fā)貨地點(diǎn):浙江省杭州市
發(fā)布時(shí)間:2025-04-02
發(fā)貨地點(diǎn):浙江省杭州市
發(fā)布時(shí)間:2025-04-02
eCTD的技術(shù)架構(gòu)與模塊要求:美國(guó)eCTD基于XML技術(shù),,嚴(yán)格遵循ICH M4框架,分為5個(gè)模塊:模塊1(地區(qū)行政信息)、模塊2(技術(shù)總結(jié)),、模塊3-5(質(zhì)量,、非臨床與臨床數(shù)據(jù))。其中,,模塊1需包含F(xiàn)DA特定的us-regional.xml文件,,涵蓋申請(qǐng)編號(hào)、聯(lián)系人和DMF授權(quán)書(shū)等行政信息,。模塊2-5需與ICH CTD全球統(tǒng)一標(biāo)準(zhǔn)一致,,但FDA對(duì)文件顆粒度要求更細(xì),例如非臨床研究報(bào)告需拆分并標(biāo)記Study ID,。PDF文件需符合FDA v4.1格式規(guī)范,,包括字體嵌入、書(shū)簽層級(jí)和超鏈接功能,。eCTD申報(bào)軟件相關(guān)技術(shù)支持,。山東賦悅科技eCTD哪家好
FDA圍繞eCTD發(fā)布了10余項(xiàng)法規(guī)指南,涵蓋格式要求,、文件生命周期,、數(shù)據(jù)安全等細(xì)節(jié),其中《ICH M2 EWG》作為綜合性技術(shù)文件,,成為企業(yè)申報(bào)的參考,。eCTD的實(shí)施提升了審評(píng)效率,通過(guò)標(biāo)準(zhǔn)化XML結(jié)構(gòu)和電子簽章技術(shù),,減少了紙質(zhì)遞交的物流與時(shí)間成本,,同時(shí)支持全生命周期管理,便于后續(xù)變更和補(bǔ)充資料的動(dòng)態(tài)更,。 美國(guó)在eCTD實(shí)施中注重與ICH國(guó)際標(biāo)準(zhǔn)的兼容性,,例如采用統(tǒng)一的CTD模塊化結(jié)構(gòu)和PDF技術(shù)規(guī)范。然而,,其區(qū)域性要求(如信封信息中的Application ID,、Submission Subtype)仍體現(xiàn)本土化特色。這種“國(guó)際框架+本地適配”的模式,,既保障了跨國(guó)藥企的申報(bào)便利,,又滿(mǎn)足了FDA的監(jiān)管需求。安徽新藥eCTD軟件eCTD申報(bào)相關(guān)技術(shù)支持,。

法規(guī)文檔管理系統(tǒng) 協(xié)同共享 RDMS可以讓跨區(qū)域,、跨部門(mén)協(xié)同真正成為1+1>2的 工作。讓頻繁的文檔共享傳輸,,版本管理,,生命周 期審批都變得輕松簡(jiǎn)單 安全合規(guī) 通過(guò)詳細(xì)的審計(jì)追蹤、電子簽名,、權(quán)限管理,、網(wǎng) 關(guān)控制,、頁(yè)面控制等技術(shù)手段,構(gòu)建安全合規(guī)的 文檔管理系統(tǒng),,通過(guò)安全驗(yàn)證與合規(guī)驗(yàn)證 統(tǒng)一文檔來(lái)源 藥品注冊(cè)是企業(yè)經(jīng)營(yíng)成果的技術(shù)資料,,由多個(gè)部門(mén) 長(zhǎng)時(shí)間匯集到法規(guī)部門(mén)。RDMS確保多部門(mén)文檔來(lái) 源統(tǒng)一,,即使人員流動(dòng)也可以快速接續(xù)工作 統(tǒng)一文檔結(jié)構(gòu) 根據(jù)不同申報(bào)類(lèi)型,,自動(dòng)生成文檔結(jié)構(gòu),讓法規(guī) 人員與跨部門(mén)同事掌握申報(bào)需要的資料需求,,降 低溝通成本,,降低經(jīng)驗(yàn)需求,避免疏忽遺漏
緊急申報(bào)與特殊通道:FDA設(shè)置緊急申報(bào)通道(如Pre-EUA和EUA),,允許在公共衛(wèi)生事件中快速提交資料,。此類(lèi)申請(qǐng)需在模塊1.19注明特殊標(biāo)識(shí),并通過(guò)ESG加急處理,。 eCTD版本兼容性與過(guò)渡策略:eCTD 4.0支持向前兼容,,允許v3.2.2文件無(wú)縫過(guò)渡。企業(yè)需在2024年前完成系統(tǒng)升級(jí),,確保XML到HL7 RPS的格式轉(zhuǎn)換,。過(guò)渡期間需同時(shí)維護(hù)舊版本系統(tǒng)。 區(qū)域差異與全球化協(xié)調(diào):美國(guó)模塊1要求嚴(yán)格,,如UUID標(biāo)識(shí)符和組合申請(qǐng)支持,,而歐盟側(cè)重文件引用合規(guī)性。FDA與PMDA,、EMA通過(guò)ICH框架協(xié)調(diào)eCTD標(biāo)準(zhǔn),,但區(qū)域特殊性仍需針對(duì)性適配。 行業(yè)影響與長(zhǎng)期價(jià)值:eCTD不是技術(shù)升級(jí),,更是全球藥品監(jiān)管一體化的驅(qū)動(dòng)力,。其標(biāo)準(zhǔn)化、可追溯性和效率提升,,推動(dòng)了跨國(guó)多中心試驗(yàn)的協(xié)同申報(bào),,加速創(chuàng)藥上市進(jìn)程,。中NDA注冊(cè)申報(bào)相關(guān)技術(shù)支持,。
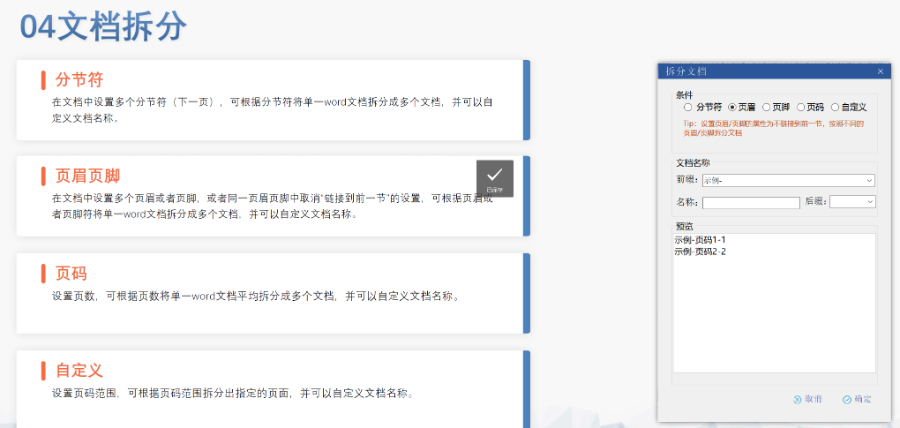
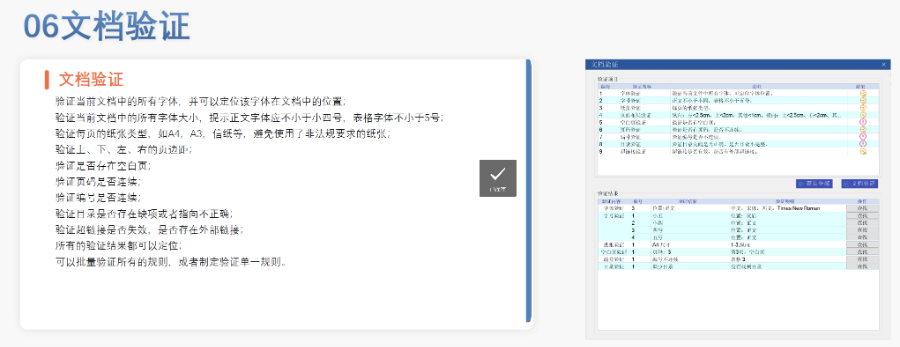
賦悅Word插件 自主研發(fā)Word插件 快速編輯:整合word常用功能按鈕,避免頻繁切換菜單,;內(nèi)置標(biāo)題,、段落、文字,、目錄,、超鏈接等的格式和樣式,,可快速設(shè)置和更文檔的格式 快速鏈接:雙擊或者拖拽的方式,制作文本超鏈接或者題注超鏈接,;可搜索全文關(guān)鍵字,,自動(dòng)制作超鏈接 文檔拆分:可根據(jù)不同的條件將word文件顆粒化,,如分節(jié)符,、頁(yè)眉、頁(yè)腳,、頁(yè)碼范圍和自定義頁(yè)碼等 PDF轉(zhuǎn)換:WORD轉(zhuǎn)PDF,,自動(dòng)判斷是否生成書(shū)簽,自動(dòng)鑲嵌所有字體,,生成PDF快速網(wǎng)頁(yè)瀏覽的PDF,,確保生成的PDF所有屬性符合法規(guī)要求 文檔驗(yàn)證:驗(yàn)證文檔的字體、字號(hào),、紙張,、頁(yè)面布局、空白頁(yè),、頁(yè)碼,、編號(hào)、目錄,、超鏈接等,,并且可以定位驗(yàn)證結(jié)果 可定制:可根據(jù)用戶(hù)需求定制格式和樣式模板澳大利亞NDA注冊(cè)申報(bào)相關(guān)技術(shù)支持。新疆生物制品eCTD
中DMF注冊(cè)申報(bào)相關(guān)技術(shù)支持,。山東賦悅科技eCTD哪家好
eCTD 4.0版本的過(guò)渡與升級(jí):FDA于2023年啟動(dòng)eCTD 4.0技術(shù)試點(diǎn),,2024年9月正式接收申請(qǐng),計(jì)劃2029年完成全過(guò)渡,。4.0版本改用HL7 RPS標(biāo)準(zhǔn)替代XML,,支持雙向通信和跨申請(qǐng)文件復(fù)用,例如同一Study ID可在IND和NDA享,。模塊1的校驗(yàn)碼從MD5升級(jí)為SHA-256,,主干文件由index.xml改為submissionunit.xml,序列號(hào)取消前導(dǎo)零(如“1”而非“0001”),。企業(yè)需同步更軟件系統(tǒng)以適應(yīng)架構(gòu),。DMF與IND申報(bào)的特殊要求:針對(duì)Type II(原料藥)和Type IV(輔料)DMF,eCTD模塊3需詳細(xì)描述生產(chǎn)工藝,、穩(wěn)定性數(shù)據(jù),,并附分析證書(shū)(COA)。FDA要求DMF持有人指定美國(guó)境內(nèi)代理人,,確保溝通效率,,且LOA(授權(quán)書(shū))需明確引用范圍,。IND安全性報(bào)告(如SUSAR)需通過(guò)eCTD模塊5.3.5提交,15天內(nèi)完成,,并嵌入CIOMS或MedWatch表格,。2024年指南強(qiáng)調(diào),臨床數(shù)據(jù)庫(kù)需以SAS XPORT格式提交,,單個(gè)文件超過(guò)4GB需拆分并說(shuō)明規(guī)則,。山東賦悅科技eCTD哪家好
賦悅科技(杭州)有限責(zé)任公司在同行業(yè)領(lǐng)域中,一直處在一個(gè)不斷銳意進(jìn)取,,不斷制造創(chuàng)新的市場(chǎng)高度,,多年以來(lái)致力于發(fā)展富有創(chuàng)新價(jià)值理念的產(chǎn)品標(biāo)準(zhǔn),在浙江省等地區(qū)的數(shù)碼,、電腦中始終保持良好的商業(yè)口碑,,成績(jī)讓我們喜悅,但不會(huì)讓我們止步,,殘酷的市場(chǎng)磨煉了我們堅(jiān)強(qiáng)不屈的意志,,和諧溫馨的工作環(huán)境,富有營(yíng)養(yǎng)的公司土壤滋養(yǎng)著我們不斷開(kāi)拓創(chuàng)新,,勇于進(jìn)取的無(wú)限潛力,,賦悅科技供應(yīng)攜手大家一起走向共同輝煌的未來(lái),回首過(guò)去,,我們不會(huì)因?yàn)槿〉昧艘稽c(diǎn)點(diǎn)成績(jī)而沾沾自喜,,相反的是面對(duì)競(jìng)爭(zhēng)越來(lái)越激烈的市場(chǎng)氛圍,我們更要明確自己的不足,,做好迎接新挑戰(zhàn)的準(zhǔn)備,,要不畏困難,激流勇進(jìn),,以一個(gè)更嶄新的精神面貌迎接大家,,共同走向輝煌回來(lái)!