�Ϻ����WˎƷeCTD�f�� �N�ķ��� �x���Ƽ�����
�l(f��)؛���c���㽭ʡ������
�l(f��)���r�g��2025-04-10
�l(f��)؛���c���㽭ʡ������
�l(f��)���r�g��2025-04-10
Σ�C�����c�����f���C�� �ڹ����l(w��i)���o���¼�����COVID-19����,��EMA���S����eCTD���У���(y��u)�Ȍ��u�P�Iģ�K�������ǔ���,����Ո�˿�ͨ�^����ͨ����Fast Track���ύ�����ˎ���eCTD�Y��,�����u���ڿɉ��s��6���¡������Ո�踽�L�U�u�����,�������Z���m(x��)�a����������,�� ������ȫ�c�L�ڴ�n �W��Ҫ��eCTD�Y�ϴ�n�������ٞ�ˎƷ���к�30�꣬EMA���÷ֲ�ʽ�惦�ͅ^(q��)�K朼��g�_���������ɴ۸�,����Ո���趨�ڂ�ݱ��ظ���,����ʹ�÷���GDPRҪ��ļ��܂�ݔ�f(xi��)�h����AS2���f�����vʷ�������w�ƺ�ʽ�D�Q����NeeS�DeCTD������ѭ�ض����gҎ(gu��)��,�� �h(hu��n)��Ч���c�ɳ��m(x��)�l(f��)չ eCTDȡ�����|�f����,���W��ÿ��p�ټs500���������ģ����u���̵Ĕ��ֻ�����̼���E�s30%,��̓�M���u���h����Ӻ����Mһ���p���˲�������,�����ϚW��2050̼�к�Ŀ�ˡ�δ��,��eCTD4.0��ͨ�^�������s���g�Mһ�����ͷ������ܺ�,������INDע��������P���g֧�֡����,����WˎƷeCTD�f��
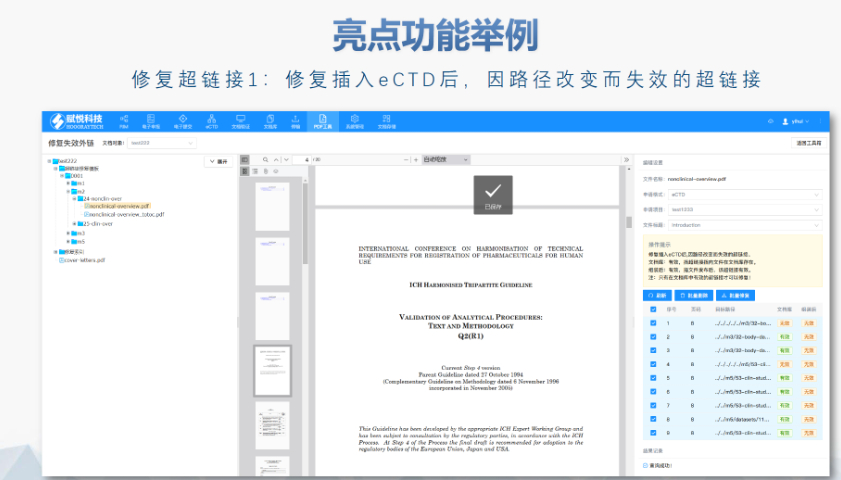
�˴�eCTD��ʩ�����ĔU���������Ӱ푡���ʩ�����ĔU��������ṩ�˸����x��,���e���ڮaƷ����NDA��ANDռ���ஔ����r��,�������ϵ�y(t��ng)�������������죬���������eCTD�U���ַe�O�B(t��i)�ȣ���Ը��Lԇ��׃,���M���^���п����������g��Ҏ(gu��)�ϵĆ��},������I(y��)�J��ͨ�^���෴�����cCDE��ͨ���܉����������w���Ч�ʺ��|��,������,������߀���R������ɻ���Ҏ(gu��)��Ϣ����ϵ�y(t��ng)������(zh��n)���e�Ǯ���Ҫ�w�Ƶ�ϵ�y(t��ng)�r,������M�猢�aƷ�w�Ƶ�eCTD,���oՓ��ϵ�y(t��ng)�w��߀�Ǻ��m(x��)���������ڹ�����������형��� �S��eCTD��ʩ�����ĔU��,�������̌����и���ĘI(y��)�ՙC��,��Ȼ�����Ї�ˎƷע���wϵ�������p��,�������MeCTD��ʩ�^���п������R���N���},�����ڃȣ���С��I(y��)�������R�Y������,����Ҫ���]�Ƿ�Ͷ���Y��ُ�I��eCTDϵ�y(t��ng),�����L�ځ�������I(y��)���Pע������ν���һ�����Ƶ��ęn�����wϵ,������������f��,���@��Ҫ��I(y��)��ǰ��Ͷ������r�g�;����M�����̃�(y��u)�����ˆT��Ӗ���V��eCTD��ʲô�W��eCTDע����ԃ���P���g֧��,��
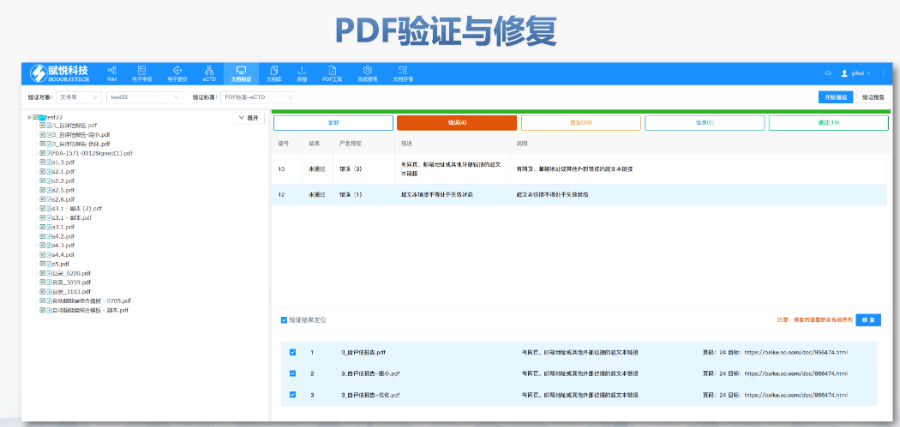
����eCTD�ď��ƌ�ʩ�r�g�c������������2017��5��5����Ҫ��ˎ��Ո��NDA��������ˎ��Ո��ANDA����������Ʒ�S����Ո��BLA�����ͨ�^eCTD��ʽ�ύ,��2018��5��5���Mһ���Uչ���R��ԇ���Ո��IND����ˎƷ���ļ���DMF��,��FDAͨ�^��(li��n)��ʳƷ��ˎƷ�ͻ��yƷ��������745A�l���_����ύ�ď�����,��������̘I(y��)��IND�Ͳ���DMF��ͣ�����,��2023�ꔵ���@ʾ��FDA���յ�eCTD��Ոռ�����_92%,����־����ӻ����u�wϵ�ij���,����I(y��)��δ��Ҏ(gu��)���ύ����ȱ��us-regional.xml�ļ����؏�����̖������ֱ�ӱ�����,��
�ļ��|����ӵĚvʷ�^�� 2017��ǰ,���������S���|�ceCTD�����ύ�����˺�����̭���|ͨ��,�������o����r�µ����⌏��,��2020����ӻ���,������IND��NDA,��ANDA��DMF���Ʋ���eCTD��ʽ,�� ϵ�y(t��ng)ƽ�_���� FDAͨ�^��ˎƷ�I(y��)�Ց���ϵ�y(t��ng)���͡�ˎƷeCTDע��ϵ�y(t��ng)�����F����Y�Ͻ��ա������c���u��ȫ���̔��ֻ�,��2022��ϵ�y(t��ng)���Ԅ����������ĕ��Ͷ������ѹ���,���p���˹����A�� ����ęn�Y����(y��u)�� ����eCTD���÷��ļ��A�Y��,�����绯�WˎƷ��ģ�K1-5�քe���������ļ�,�����Y��桢�|��������,��2020��������R��ԇ���족�b��Ҫ��,���������������ԡ��Ĵ�����DMFע��������P���g֧��,��
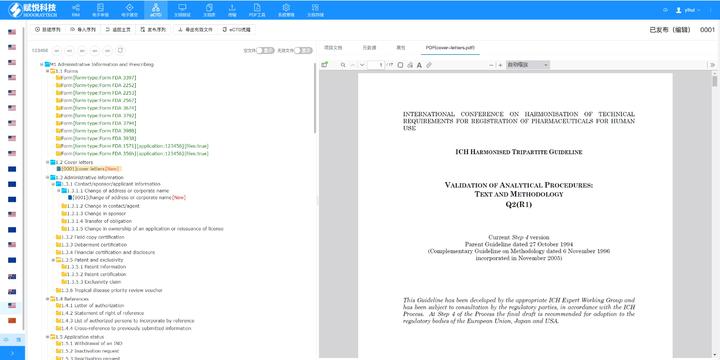
2015��l(f��)�����P��ˎƷ�t(y��)����е���u�����ƶȵ���Ҋ�������ˎ�O(ji��n)���Ŀ��,����eCTD�{�����ˎ�O(ji��n)���ֻ���(zh��n)�ԡ�2017��,���Ї�����ICH�����H����ˎƷע�Լ��g�f(xi��)�{����,���ɞ�ȫ��ڰ˂��O(ji��n)�ܙC���ɆT�������c���H�˜ʽ�܉,��2018��,������ˎ�O(ji��n)�֣�NMPA�����eCTD�ęn����ϵ�y(t��ng)�Иˣ����Ϻ������c��LORENZ��������gƽ�_,����־�����g���A�Oʩ�����,�� Ҏ(gu��)���ƶ��cԇ�c�A�Σ�2019-2023�꣩ 2019-2020�꣬CDE��ˎƷ���u���ģ��l(f��)����eCTD���gҎ(gu��)��������C�˜ʡ���������Ҋ��,�����M����݆��I(y��)�yԇ,��2021�꣬NMPA���_���Wˎ1�,��5.1�������Ʒ1�������Ո�m��eCTD,��2022�ꌍʩ������eCTD��ʽ����2023��ȡ�����|�Y���ύ,����eCTD��_�춨���A,�� ��ʩ�c�Uչ�A�Σ�2024-2025�꣩ 2024��3�¸��������gҪ��7���ӾW�j��ݔԇ�c,��2025��1��27��,��NMPA��eCTD�m�÷����U������ˎ1-5��R��ԇ������Ո,��������Ʒ1-3�ȫ���̣����wˎ,������ˎ���������ˎ,�����F�c���H�������ģʽͬ�����Ĵ�������eCTD������P���g֧��,��ɽ�|���Hע��eCTD�ԃr��
�W��NDAע��������P���g֧��,���Ϻ����WˎƷeCTD�f��
eCTD�ķ�Ҏ(gu��)����c���gҎ(gu��)�����W��eCTD�ķ�Ҏ(gu��)�Ӽ�����ָ�ϣ�Guidelines��,��ָ�Directive���ͷ�Ҏ(gu��)��Regulation��,�����У���Ҏ(gu��)����CTR������ֱ�ӷ���Ч��,����ָ�ϣ���ICH eCTDҎ(gu��)�����t�鼼�g�����ṩ����,��eCTD�ĽY������ϚW��ģ�K1Ҏ(gu��)����DTD 3.0+�������������ļ���ģ�K1��,���|��������ģ�K3�����R���о���棨ģ�K5���ȃ���,����ͨ�^XML�ļ����F������(li��n)������,��CEP���W��ˎ���m�����C������eCTD�����Ϊ������ŷ⣨Envelope����ģ�K1,����ָ�����R����UUID���Դ_�����g��Ҏ(gu��)�ԡ����,����WˎƷeCTD�f��
�x���Ƽ������ݣ�����؟�ι�˾��ͬ�ИI(y��)�I����,��һֱ̎��һ�������J���Mȡ���������섓(chu��ng)�µ��Ј��߶�,�������ԁ������ڰl(f��)չ���Є�(chu��ng)�rֵ����ĮaƷ�˜�,�����㽭ʡ�ȵ^(q��)�Ĕ��a����X��ʼ�K�������õ��̘I(y��)�ڱ�,���ɿ��҂�ϲ��,���������҂�ֹ����������Ј�ĥ�����҂��ԏ���������־,�����C��ܰ�Ĺ����h(hu��n)��,�����РI�B(y��ng)�Ĺ�˾�������B(y��ng)���҂������_��(chu��ng)�£������Mȡ�ğo�ޝ���,���x���Ƽ������y�ִ��һ������ͬ�x�͵�δ��,�������^ȥ���҂��������ȡ����һ�c�c�ɿ���մմ��ϲ,���෴�����挦����Խ��Խ���ҵ��Ј��Շ�,���҂���Ҫ���_�Լ��IJ��㣬����ӭ��������(zh��n)�Ĝʂ�,��Ҫ��η���y,���������M,����һ�������µľ�����òӭ�Ӵ�ң���ͬ�����x�ͻ�,��