eCTD驗證標準的嚴格性與分類:歐盟對eCTD的驗證要求分為“錯誤”“警告”和“提示信息”三級,,其中“錯誤”項直接導(dǎo)致申報被拒。驗證項目涵蓋六大類共149條,,包括文件命名規(guī)范(如路徑長度限制),、PDF可讀性(禁止密碼保護),、XML骨架文件完整性等,。例如,,文件擴展名必須符合規(guī)范(如.xpt用于臨床數(shù)據(jù)集),,而文件夾層級需避免空目錄或混合存放文件。相較于中國《電子申報驗證標準》的簡化版(54條),,歐盟的驗證體系更為復(fù)雜,,體現(xiàn)了其高標準的技術(shù)監(jiān)管,。加拿大eCTD注冊外包相關(guān)技術(shù)支持,。重慶化學(xué)藥品eCTD
爭議解決與法律救濟 若申請人對審評結(jié)果有異議,可向EMA的CHMP申請重審查,,或在歐盟法院提起行政訴訟,。eCTD的完整提交記錄可作為法律證據(jù),證明申請人已履行合規(guī)義務(wù),。EDQM設(shè)立仲裁委員會,,處理CEP程序中的技術(shù)爭議。 行業(yè)趨勢與競爭格局 全球eCTD服務(wù)市場年增長率達12%,,歐盟占據(jù)35%份額,,主要服務(wù)商包括PharmaLex、Certara等,。頭部藥企通過自建IT團隊降低成本,,而中小型企業(yè)依賴外包以專注研發(fā)。人工智能(AI)在文件自動生成和審評意見預(yù)測中的應(yīng)用逐漸增多,。 患者參與與透明度提升 EMA通過公開eCTD摘要(如模塊2.5臨床概要)增強審評透明度,,患者組織可提交意見影響審評決策,。部分成員國要求模塊1包含患者語言版本說明書,,以提升用藥依從性。未來,,eCTD4.0或支持直接鏈接患者反饋平臺,,實現(xiàn)全生命周期互動。山東化學(xué)藥品eCTD服務(wù)價格加拿大IND注冊申報相關(guān)技術(shù)支持,。
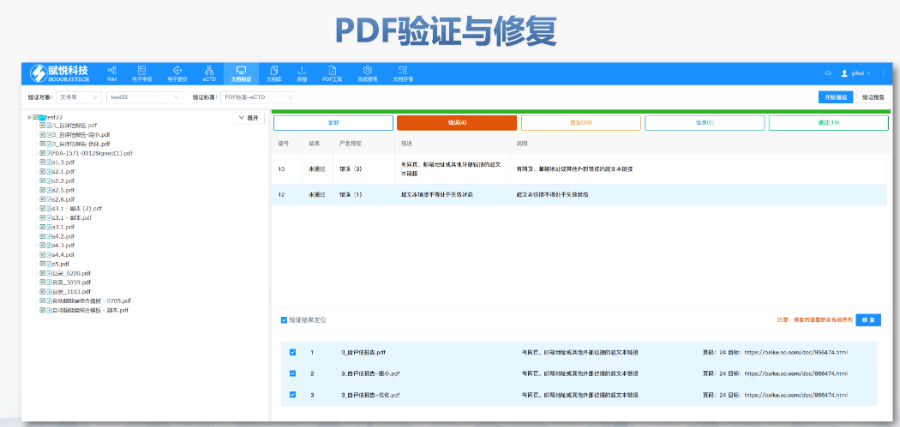
賦悅eCTD系統(tǒng) 文件驗證與修復(fù) 支持自動驗證文件格式(如PDF屬性,、字體嵌入,、超鏈接完整性等),并一鍵修復(fù)不符合法規(guī)要求的文件,。例如,,系統(tǒng)會自動檢查XML主干文件的結(jié)構(gòu)合規(guī)性,確保符合中國,、美國,、歐盟等地區(qū)的eCTD法規(guī)標準。 eCTD組裝與發(fā)布 可自動生成符合CTD結(jié)構(gòu)的電子文檔包,,包括XML主干文件,、文件夾命名規(guī)范及序列號管理(如申請?zhí)?序列號文件夾自動生成),并支持超鏈接和書簽的批量創(chuàng)建,。例如,,初次提交的序列號為0000,后續(xù)每次提交自動遞增,。 生命周期管理 支持文件全生命周期操作(增,、增補、替換,、刪除),,并通過序列號疊加直觀顯示各章節(jié)文件的有效性,覆蓋從初次提交到年報,、撤市的全流程管理,。 協(xié)同與權(quán)限管理 基于B/S架構(gòu)(瀏覽器/服務(wù)器),支持云端或本地靈活部署,,全集團賬號通用,。提供多用戶協(xié)作功能,包括權(quán)限分級,、審計追蹤,、文件版本控制等。 法規(guī)支持與專業(yè)服務(wù) 內(nèi)置符合中國CDE,、美國FDA,、歐盟EMA等法規(guī)的模板,同時提供注冊咨詢,、資料撰寫,、eCTD格式代轉(zhuǎn)等全流程支持,團隊擁有17年藥品注冊經(jīng)驗,。
ANDA一般不需要提供臨床前(動物)和臨床(人體)數(shù)據(jù)來證明其安全性和有效性(即免毒理和臨床),,作為替代,申請人必須合理證明其產(chǎn)品與原研藥相比是生物等效的,。 按照《聯(lián)邦食品,、藥品和化妝品法》第 505(j)章要求,,擬向FDA遞交申請ANDA的藥品需符合以下條件: 仿制藥必須依照FDA《經(jīng)過醫(yī)療等同性評價批準的藥品》(俗稱"橙皮書")上所列,由FDA選定的RLD/RS進行對照仿制; 活性成份,、劑型,、規(guī)格、給藥途徑,、適應(yīng)癥,,要與RLD相同; 仿制藥必須證明與RLD在生物效果上等同,,即具有生物等效性,; 必須按照美國聯(lián)邦管理法21 CFR遵行藥品生產(chǎn)管理規(guī)范控制生產(chǎn)過程,; 無論中國還是美國,要求仿制藥的質(zhì)量必須等同或者是高于參比制劑的,這是獲批的基本要點,; 注意:如果原研藥未被列為RLD,,申請人可以提出公民,,向FDA申請,。美國eCTD注冊外包相關(guān)技術(shù)支持。

審評效率與時間線優(yōu)化 eCTD的標準化縮短了審評周期:集中程序平均審評時間從18個月降至12個月,,互認程序可在90天內(nèi)完成成員國意見協(xié)調(diào),。自動化驗證工具減少了格式錯誤導(dǎo)致的退審率,但復(fù)雜藥學(xué)數(shù)據(jù)的科學(xué)審評仍需較長時間,。申請人可通過預(yù)提交會議(Pre-submission meeting)提前溝通技術(shù)細節(jié),,規(guī)避潛在延誤。 區(qū)域協(xié)作與全球互認 歐盟通過互認程序與澳大利亞,、加拿大等國實現(xiàn)eCTD數(shù)據(jù)共享,,CEP證書在40余個非歐盟國家有效。然而,,模塊一區(qū)域信息的差異性仍要求申請人定制化調(diào)整,,例如亞洲國家可能要求附加穩(wěn)定性研究數(shù)據(jù)。ICH的協(xié)調(diào)作用有助于減少重復(fù)提交,,但完全全球化仍需解決法規(guī)和技術(shù)壁壘,。 技術(shù)工具與行業(yè)生態(tài) 主流eCTD編輯軟件(如Lorenz、Extedo)支持歐盟區(qū)域模板的自動化生成,,并與驗證工具集成實現(xiàn)一鍵校驗,。云平臺解決方案逐漸普及,支持多國團隊協(xié)同編輯和實時版本控制,。然而,,軟件采購和維護成本較高,,中小企業(yè)常選擇外包給專業(yè)服務(wù)商完成遞交,。美國API的DMF申報相關(guān)技術(shù)支持,。山東CDE eCTD服務(wù)放心可靠
eCTD申報軟件相關(guān)技術(shù)支持。重慶化學(xué)藥品eCTD
緊急申報與特殊通道:FDA設(shè)置緊急申報通道(如Pre-EUA和EUA),,允許在公共衛(wèi)生事件中快速提交資料,。此類申請需在模塊1.19注明特殊標識,并通過ESG加急處理,。 eCTD版本兼容性與過渡策略:eCTD 4.0支持向前兼容,,允許v3.2.2文件無縫過渡。企業(yè)需在2024年前完成系統(tǒng)升級,,確保XML到HL7 RPS的格式轉(zhuǎn)換,。過渡期間需同時維護舊版本系統(tǒng)。 區(qū)域差異與全球化協(xié)調(diào):美國模塊1要求嚴格,,如UUID標識符和組合申請支持,,而歐盟側(cè)重文件引用合規(guī)性。FDA與PMDA,、EMA通過ICH框架協(xié)調(diào)eCTD標準,,但區(qū)域特殊性仍需針對性適配。 行業(yè)影響與長期價值:eCTD不是技術(shù)升級,,更是全球藥品監(jiān)管一體化的驅(qū)動力,。其標準化、可追溯性和效率提升,,推動了跨國多中心試驗的協(xié)同申報,,加速創(chuàng)藥上市進程。重慶化學(xué)藥品eCTD
賦悅科技(杭州)有限責(zé)任公司在同行業(yè)領(lǐng)域中,,一直處在一個不斷銳意進取,,不斷制造創(chuàng)新的市場高度,多年以來致力于發(fā)展富有創(chuàng)新價值理念的產(chǎn)品標準,,在浙江省等地區(qū)的數(shù)碼,、電腦中始終保持良好的商業(yè)口碑,成績讓我們喜悅,,但不會讓我們止步,,殘酷的市場磨煉了我們堅強不屈的意志,和諧溫馨的工作環(huán)境,,富有營養(yǎng)的公司土壤滋養(yǎng)著我們不斷開拓創(chuàng)新,,勇于進取的無限潛力,賦悅科技供應(yīng)攜手大家一起走向共同輝煌的未來,,回首過去,,我們不會因為取得了一點點成績而沾沾自喜,相反的是面對競爭越來越激烈的市場氛圍,,我們更要明確自己的不足,,做好迎接新挑戰(zhàn)的準備,,要不畏困難,激流勇進,,以一個更嶄新的精神面貌迎接大家,,共同走向輝煌回來!