歐盟eCTD的歷史沿革與強制實施 歐盟自2003年逐步推進(jìn)eCTD(電子通用技術(shù)文檔)的標(biāo)準(zhǔn)化進(jìn)程,,初要求藥注冊申請(MAA)采用CTD格式。2010年,,集中審評程序(CP)率先強制使用eCTD,,隨后分散程序(DCP)和互認(rèn)程序(MRP)分別于2015年、2017年跟進(jìn),。至2019年,,歐盟要求所有國家程序(NP)的注冊申請均以eCTD格式提交,標(biāo)志著其電子遞交體系的成熟,。2024年,,EMA啟動eCTD4.0試點項目,旨在提升技術(shù)兼容性與審評效率,。 eCTD驗證標(biāo)準(zhǔn)的迭代與關(guān)鍵更 歐盟的驗證標(biāo)準(zhǔn)歷經(jīng)多次調(diào)整,,例如2025年3月啟用的eCTD3.1區(qū)域模板和驗證規(guī)則v8.1,對文件結(jié)構(gòu),、元數(shù)據(jù)和內(nèi)容完整性提出更嚴(yán)格的要求,。標(biāo)準(zhǔn)引入的“追蹤表(Tracking Table)”強制校驗規(guī)則(如15.11和15.12)曾導(dǎo)致CEP(歐洲藥典適用性證書)遞交,后通過允許占位文件臨時解決,。與早期版本相比,,v8.1強化了對模塊一區(qū)域信息的邏輯驗證,并細(xì)化了對PDF書簽,、超鏈接的規(guī)范性檢查,。歐盟IND注冊申報相關(guān)技術(shù)支持。浙江仿制藥eCTD供應(yīng)商
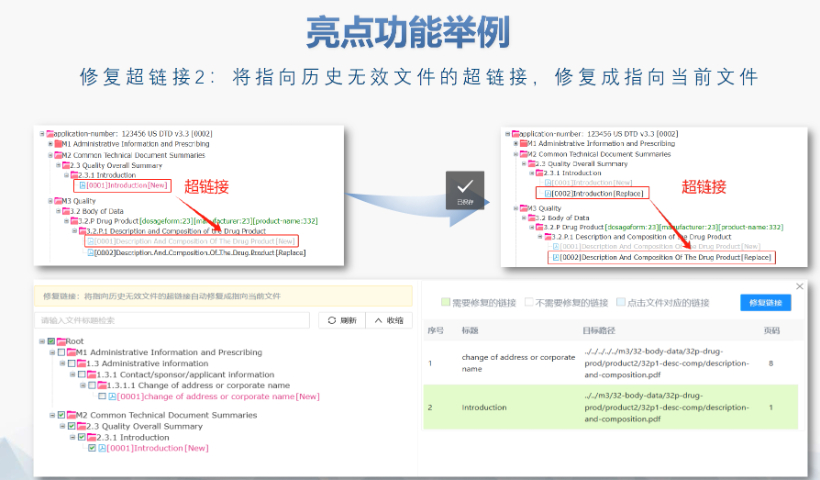
FDA圍繞eCTD發(fā)布了10余項法規(guī)指南,涵蓋格式要求,、文件生命周期,、數(shù)據(jù)安全等細(xì)節(jié),其中《ICH M2 EWG》作為綜合性技術(shù)文件,,成為企業(yè)申報的參考,。eCTD的實施提升了審評效率,通過標(biāo)準(zhǔn)化XML結(jié)構(gòu)和電子簽章技術(shù),,減少了紙質(zhì)遞交的物流與時間成本,,同時支持全生命周期管理,便于后續(xù)變更和補充資料的動態(tài)更,。 美國在eCTD實施中注重與ICH國際標(biāo)準(zhǔn)的兼容性,,例如采用統(tǒng)一的CTD模塊化結(jié)構(gòu)和PDF技術(shù)規(guī)范。然而,,其區(qū)域性要求(如信封信息中的Application ID,、Submission Subtype)仍體現(xiàn)本土化特色。這種“國際框架+本地適配”的模式,,既保障了跨國藥企的申報便利,,又滿足了FDA的監(jiān)管需求。浙江仿制藥eCTD供應(yīng)商加拿大IND注冊申報相關(guān)技術(shù)支持,。

歐洲藥品管理局:集中審評程序由歐洲藥品管理局(European Medicines Agency, EMA)負(fù)責(zé)協(xié)調(diào),。 人用藥品委員會:人用藥品委員會(Committee for Medicinal Products for Human Use, CHMP)負(fù)責(zé)提供科學(xué)意見。 歐盟委員會:CHMP的意見隨后被提交給歐盟委員會(European Commission, EC),,由歐盟委員會做出是否授權(quán)的終決定,。這個決定在整個歐盟都是具有法律約束力的。 審批過程: 申請人向EMA提交申請,,包括eCTD(電子通用技術(shù)文檔)格式的藥品注冊文檔,。 EMA的CHMP分配一個科學(xué)評估團(tuán)隊(Rapporteur和Co-Rapporteur),負(fù)責(zé)初步評估,。 CHMP基于評估團(tuán)隊的報告提供科學(xué)意見,。 歐盟委員會根據(jù)CHMP的意見做出終決定,批準(zhǔn)或拒絕藥品上市,。 授權(quán)范圍 如果藥品獲得批準(zhǔn),,將獲得在整個歐盟、冰島,、列支敦士登和挪威有效的上市許可(Central Marketing Authorisation, CMA),。
內(nèi)容與格式檢查Word預(yù)處理:需檢查拼寫、縮略語,、單位格式(如),,設(shè)置多級列表自動編號(如),,統(tǒng)一字體(宋體/TimesNewRoman)和段落格式。重復(fù)內(nèi)容處理:相同劑型不同規(guī)格可共用模塊3,,但需區(qū)分包裝系統(tǒng)(如,、)。外文資料:中文在前,、原文在后,,參考文獻(xiàn)需中英文對照并建立跨網(wǎng)頁鏈接。使用符合ICH標(biāo)準(zhǔn)的eCTD編輯器自動生成XML骨架和MD5校驗值,,拖拽PDF文件構(gòu)建結(jié)構(gòu)樹,。序列管理:序列號從0000開始遞增,每次提交需更新序列,,生命周期狀態(tài)(New/Replace/Delete)需在XML中明確標(biāo)注,。驗證與遞交:確保無驗證錯誤(如書簽缺失、超鏈接斷鏈),,通過ESG等電子通道傳輸,,光盤封面需包含申請?zhí)柡托蛄刑枴H芷诠芾戆姹荆和ㄟ^軟件實現(xiàn)網(wǎng)頁簽入/簽出,、審批流程,支持歷史版本追溯,。變更管理:增補(Append)和替換(Replace)需關(guān)聯(lián)原始序列,,刪除(Delete)需徹底移除無效文件。 澳大利亞NDA注冊申報相關(guān)技術(shù)支持,。

經(jīng)濟(jì)影響與成本效益 盡管初期投入較高(平均每企業(yè)需50萬歐元),,但eCTD可減少30%的審評延遲成本,長期效益,。仿制藥企業(yè)通過eCTD復(fù)用原研數(shù)據(jù),,節(jié)省80%的申報準(zhǔn)備時間。歐盟預(yù)算撥款2億歐元資助中小企業(yè)完成數(shù)字化轉(zhuǎn)型,。 倫理審查與數(shù)據(jù)隱私 eCTD中的患者數(shù)據(jù)需匿名化處理,,符合《通用數(shù)據(jù)保護(hù)條例》(GDPR)要求。臨床試驗?zāi)K(模塊5)的提交需附帶倫理委員會批準(zhǔn)文件,,且區(qū)域版本需體現(xiàn)各國倫理審查差異,。AI輔助匿名化工具在保護(hù)隱私的同時提升數(shù)據(jù)處理效率。 技術(shù)融合與跨領(lǐng)域應(yīng)用 eCTD格式擴(kuò)展至醫(yī)療器械和保健品領(lǐng)域,,歐盟試點eCTD-MDR項目整合ISO標(biāo)準(zhǔn),。基因產(chǎn)品的eCTD需附加生物安全數(shù)據(jù)庫,,并與歐盟基因庫實時同步,。未來,,eCTD或與電子健康檔案(EHR)系統(tǒng)對接,支持個性化用藥,。 持續(xù)改進(jìn)與行業(yè)反饋機制 EMA每年發(fā)布eCTD實施報告,,分析常見錯誤并更指南。行業(yè)聯(lián)盟(如EFPIA)通過定期研討會向監(jiān)管機構(gòu)反饋技術(shù)痛點,,推動標(biāo)準(zhǔn)優(yōu)化,。開放式API接口的推廣將促進(jìn)eCTD工具鏈的互操作性,降低技術(shù)鎖定風(fēng)險,。美國IND注冊申報相關(guān)技術(shù)支持,。廣東eCTD服務(wù)放心可靠
瑞士DMF注冊申報相關(guān)技術(shù)支持。浙江仿制藥eCTD供應(yīng)商
技術(shù)壁壘與興市場挑戰(zhàn) 非洲和東南亞國家逐步采納eCTD,,但其IT基礎(chǔ)設(shè)施薄弱導(dǎo)致實施進(jìn)度滯后,。歐盟通過“eCTD全球化倡議”提供技術(shù)援助,幫助興市場建立驗證體系和培訓(xùn)中心,�,?鐕幤笮栳槍Σ煌瑓^(qū)域定制遞交策略,例如在模塊1附加本地穩(wěn)定性數(shù)據(jù),。 監(jiān)管科學(xué)與創(chuàng)激勵 eCTD支持真實世界證據(jù)(RWE)和適應(yīng)性臨床試驗設(shè)計的整合,,加速創(chuàng)藥上市。EMA的PRIME計劃為突破性療法提供eCTD快速通道,,允許分階段提交模塊數(shù)據(jù),。孤兒藥和兒科藥的eCTD序列可享受費用減免和優(yōu)先審評。 供應(yīng)鏈安全與審計追蹤 eCTD的XML主干文件記錄所有提交版本,,支持供應(yīng)鏈問題的追溯分析,。原料藥CEP持有者需及時更變更信息,確保下游制劑廠商獲取數(shù)據(jù),。區(qū)塊鏈技術(shù)試點用于追蹤eCTD數(shù)據(jù)流,,防止篡改和未授權(quán)訪問。 文化差異與實施障礙 部分南歐國家偏好傳統(tǒng)紙質(zhì)流程,,導(dǎo)致eCTD推廣阻力較大,。EMA通過多語種培訓(xùn)材料和區(qū)域協(xié)調(diào)員制度促進(jìn)文化適應(yīng)。行業(yè)需調(diào)整管理思維,,將eCTD從“合規(guī)負(fù)擔(dān)”轉(zhuǎn)化為“競爭優(yōu)勢”,。浙江仿制藥eCTD供應(yīng)商
賦悅科技(杭州)有限責(zé)任公司是一家有著先進(jìn)的發(fā)展理念,先進(jìn)的管理經(jīng)驗,,在發(fā)展過程中不斷完善自己,,要求自己,不斷創(chuàng)新,,時刻準(zhǔn)備著迎接更多挑戰(zhàn)的活力公司,,在浙江省等地區(qū)的數(shù)碼,、電腦中匯聚了大量的人脈以及客戶資源,在業(yè)界也收獲了很多良好的評價,,這些都源自于自身的努力和大家共同進(jìn)步的結(jié)果,,這些評價對我們而言是最好的前進(jìn)動力,也促使我們在以后的道路上保持奮發(fā)圖強,、一往無前的進(jìn)取創(chuàng)新精神,,努力把公司發(fā)展戰(zhàn)略推向一個新高度,在全體員工共同努力之下,,全力拼搏將共同賦悅科技供應(yīng)和您一起攜手走向更好的未來,,創(chuàng)造更有價值的產(chǎn)品,我們將以更好的狀態(tài),,更認(rèn)真的態(tài)度,,更飽滿的精力去創(chuàng)造,去拼搏,,去努力,,讓我們一起更好更快的成長!