美國于2003年成為全球早采用eCTD(電子通用技術(shù)文檔)的國家之一,,初由CDER和CBER作為電子提交平臺試點。2008年起,,eCTD正式成為藥申請(NDA)和生物制品許可申請(BLA)的標(biāo)準(zhǔn)格式,,并在2012年通過《藥申報者付費法案》(PDUFA)進一步強化其法律地位。至2017年,,F(xiàn)DA強制要求所有藥申請(NDA),、簡略藥申請(ANDA)及藥物主文件(DMF)必須采用eCTD格式提交,標(biāo)志著其從可選到強制的轉(zhuǎn)型,。這一進程在2018年擴展至臨床試驗申請(IND),,終實現(xiàn)全類型藥品注冊的電子化覆蓋美國ANDA注冊申報相關(guān)技術(shù)支持。江蘇賦悅科技eCTD性價比
eCTD的實施為監(jiān)管機構(gòu)和企業(yè)帶來了多重機遇,。電子化申報資料能夠極大地加速審評效率,,減少人為判斷錯誤和數(shù)據(jù)混淆的情況,從而提高審評的準(zhǔn)確性和速度,。同時,,eCTD帶來的數(shù)據(jù)標(biāo)準(zhǔn)化機遇使得全球監(jiān)管機構(gòu)的資料內(nèi)容和電子格式得以統(tǒng)一,有助于在不同監(jiān)管機構(gòu)之間進行數(shù)據(jù)傳輸和共享,。這對于提升全球監(jiān)管效率和行業(yè)研發(fā)效率具有重要意義,。 此外,eCTD的實施還促進了國際合作,,構(gòu)建了全球監(jiān)管的底層大數(shù)據(jù)基礎(chǔ),。對于企業(yè)而言,eCTD提供了一個規(guī)范化的研發(fā)活動模板,,有助于降低與監(jiān)管機構(gòu)溝通的成本,,提高申報效率。特別是對于國內(nèi)的生物技術(shù)企業(yè)而言,,eCTD的實施更是具有重要意義,,有助于這些企業(yè)更好地走向國際市場,。然而,中小企業(yè)在享受這些機遇的同時,,也面臨著技術(shù)和成本壓力,。eCTD的實施需要專門的團隊進行系統(tǒng)維護和開發(fā),這對于中小企業(yè)來說是一筆不小的開支,。同時,,數(shù)據(jù)安全問題也是企業(yè)關(guān)注的焦點。 此次CDE擴大eCTD實施范圍對行業(yè)而言是一個積極的風(fēng)向標(biāo),。短期內(nèi),,企業(yè)面臨的挑戰(zhàn)包括適應(yīng)更高要求的技術(shù)規(guī)范并提高文件質(zhì)量、和eCTD出版系統(tǒng)的磨合以及進行eCTD知識的跨職能培訓(xùn)等,。 江蘇NDAeCTD名稱加拿大ANDA注冊申報相關(guān)技術(shù)支持,。
GDUFA III框架與費用分類 2022年更的GDUFA III將費用分為ANDA申請費、DMF認(rèn)證費,、項目費及設(shè)施費四類,,實施周期至2027年。2025財年ANDA費用漲至約22萬美元,,較2024年增幅達(dá)27.5%,,反映審評成本上升。 ANDA申請費規(guī)則 費用需在提交時繳納,,若申請被拒可退還75%,。重提交視為申請,需再次繳費,。關(guān)聯(lián)API的工廠數(shù)量影響總費用,,例如某ANDA引用3個API且涉及6家工廠,需支付6倍DMF費用,。 DMF費用機制 II類原料藥DMF需在引用前繳費,,一次性支付約5.3萬美元(2025財年)。未繳費DMF不得用于支持ANDA,,否則觸發(fā)退審,。 項目費分級管理 根據(jù)企業(yè)獲批ANDA數(shù)量分為大、中,、小型三級,,2025年大型企業(yè)年費約34萬美元。附屬公司ANDA數(shù)量合并計算,,繳費責(zé)任可由母公司或任一附屬公司承擔(dān),。
危機應(yīng)對與應(yīng)急遞交機制 在公共衛(wèi)生緊急事件(如COVID-19)中,,EMA允許簡化eCTD序列,,優(yōu)先審評關(guān)鍵模塊并暫緩非數(shù)據(jù)。申請人可通過快速通道(Fast Track)提交疫苗或藥物的eCTD資料,審評周期可壓縮至6個月,。此類申請需附風(fēng)險評估報告,,并承諾后續(xù)補交完整數(shù)據(jù)。 數(shù)據(jù)安全與長期存檔 歐盟要求eCTD資料存檔期限至少為藥品上市后30年,,EMA采用分布式存儲和區(qū)塊鏈技術(shù)確保數(shù)據(jù)不可篡改,。申請人需定期備份本地副本,并使用符合GDPR要求的加密傳輸協(xié)議(如AS2)遞交,。歷史數(shù)據(jù)的遷移和格式轉(zhuǎn)換(如NeeS轉(zhuǎn)eCTD)需遵循特定技術(shù)規(guī)范,。 環(huán)保效益與可持續(xù)發(fā)展 eCTD取代紙質(zhì)遞交后,歐盟每年減少約500噸紙張消耗,,審評流程的數(shù)字化降低碳足跡約30%,。虛擬審評會議和電子簽名進一步減少了差旅需求,契合歐盟2050碳中和目標(biāo),。未來,,eCTD4.0將通過數(shù)據(jù)壓縮技術(shù)進一步降低服務(wù)器能耗。瑞士eCTD注冊咨詢相關(guān)技術(shù)支持,。
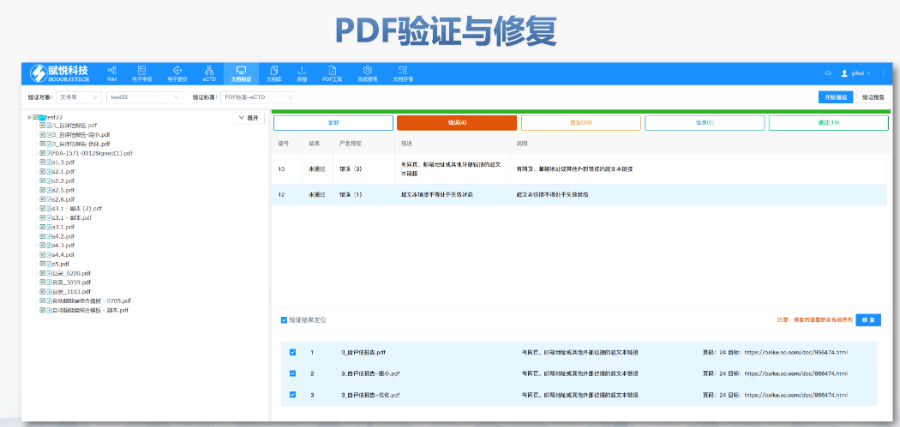
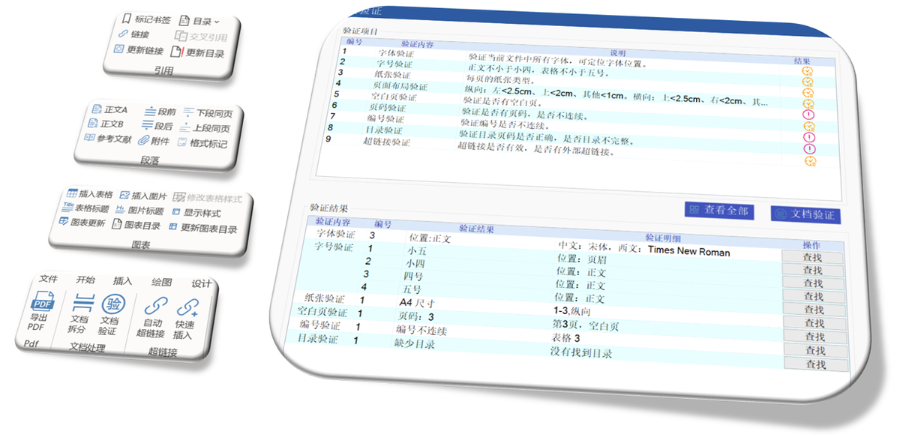
賦悅Word插件 自主研發(fā)Word插件 快速編輯:整合word常用功能按鈕,,避免頻繁切換菜單;內(nèi)置標(biāo)題,、段落,、文字、目錄,、超鏈接等的格式和樣式,,可快速設(shè)置和更文檔的格式 快速鏈接:雙擊或者拖拽的方式,制作文本超鏈接或者題注超鏈接,;可搜索全文關(guān)鍵字,,自動制作超鏈接 文檔拆分:可根據(jù)不同的條件將word文件顆粒化,,如分節(jié)符,、頁眉、頁腳,、頁碼范圍和自定義頁碼等 PDF轉(zhuǎn)換:WORD轉(zhuǎn)PDF,,自動判斷是否生成書簽,自動鑲嵌所有字體,,生成PDF快速網(wǎng)頁瀏覽的PDF,,確保生成的PDF所有屬性符合法規(guī)要求 文檔驗證:驗證文檔的字體、字號,、紙張,、頁面布局,、空白頁、頁碼,、編號,、目錄、超鏈接等,,并且可以定位驗證結(jié)果 可定制:可根據(jù)用戶需求定制格式和樣式模板瑞士IND注冊申報相關(guān)技術(shù)支持,。山東CDE eCTD
美國NDA注冊申報相關(guān)技術(shù)支持。江蘇賦悅科技eCTD性價比
eCTD的法規(guī)框架與技術(shù)規(guī)范:歐盟eCTD的法規(guī)層級包括指南(Guidelines),、指令(Directive)和法規(guī)(Regulation),。其中,法規(guī)(如CTR)具有直接法律效力,,而指南(如ICH eCTD規(guī)范)則為技術(shù)操作提供參考,。eCTD的結(jié)構(gòu)需符合歐盟模塊1規(guī)范(DTD 3.0+),包含行政文件(模塊1),、質(zhì)量數(shù)據(jù)(模塊3)及臨床研究報告(模塊5)等內(nèi)容,,并通過XML文件實現(xiàn)數(shù)據(jù)互聯(lián)。例如,,CEP(歐洲藥典適用性證書)的eCTD申報需單獨構(gòu)建信封(Envelope)和模塊1,,并指定標(biāo)識符(UUID)以確保技術(shù)合規(guī)性。江蘇賦悅科技eCTD性價比