緊急申報與特殊通道:FDA設(shè)置緊急申報通道(如Pre-EUA和EUA),,允許在公共衛(wèi)生事件中快速提交資料,。此類申請需在模塊1.19注明特殊標(biāo)識,并通過ESG加急處理,。 eCTD版本兼容性與過渡策略:eCTD 4.0支持向前兼容,,允許v3.2.2文件無縫過渡,。企業(yè)需在2024年前完成系統(tǒng)升級,確保XML到HL7 RPS的格式轉(zhuǎn)換,。過渡期間需同時維護(hù)舊版本系統(tǒng),。 區(qū)域差異與全球化協(xié)調(diào):美國模塊1要求嚴(yán)格,如UUID標(biāo)識符和組合申請支持,,而歐盟側(cè)重文件引用合規(guī)性,。FDA與PMDA、EMA通過ICH框架協(xié)調(diào)eCTD標(biāo)準(zhǔn),,但區(qū)域特殊性仍需針對性適配,。 行業(yè)影響與長期價值:eCTD不是技術(shù)升級,更是全球藥品監(jiān)管一體化的驅(qū)動力,。其標(biāo)準(zhǔn)化,、可追溯性和效率提升,推動了跨國多中心試驗的協(xié)同申報,,加速創(chuàng)藥上市進(jìn)程,。澳大利亞IND注冊申報相關(guān)技術(shù)支持。浙江中國eCTD便宜
法規(guī)文檔管理系統(tǒng) 協(xié)同共享 RDMS可以讓跨區(qū)域,、跨部門協(xié)同真正成為1+1>2的 工作,。讓頻繁的文檔共享傳輸,版本管理,,生命周 期審批都變得輕松簡單 安全合規(guī) 通過詳細(xì)的審計追蹤,、電子簽名、權(quán)限管理,、網(wǎng) 關(guān)控制,、頁面控制等技術(shù)手段,構(gòu)建安全合規(guī)的 文檔管理系統(tǒng),,通過安全驗證與合規(guī)驗證 統(tǒng)一文檔來源 藥品注冊是企業(yè)經(jīng)營成果的技術(shù)資料,,由多個部門 長時間匯集到法規(guī)部門。RDMS確保多部門文檔來 源統(tǒng)一,,即使人員流動也可以快速接續(xù)工作 統(tǒng)一文檔結(jié)構(gòu) 根據(jù)不同申報類型,,自動生成文檔結(jié)構(gòu),讓法規(guī) 人員與跨部門同事掌握申報需要的資料需求,,降 低溝通成本,,降低經(jīng)驗需求,避免疏忽遺漏浙江國際注冊eCTD推薦美國注冊鄧白氏號申請相關(guān)技術(shù)支持,。
電子簽章與傳輸安全 文件需經(jīng)AES-256加密后刻錄至不可擦寫光盤,,并附MD5校驗碼,。光盤損壞或病毒污染將觸發(fā)重遞交流程,原載體按銷毀程序處理,。 審評與核查協(xié)同 自2018年起,,F(xiàn)DA要求提交兩套光盤分別用于審評和現(xiàn)場核查,2022年調(diào)整為“1套審評+1套核查+1套專項資料”模式,,提升流程效率,。 國際化兼容性增強(qiáng) 美國eCTD系統(tǒng)支持與歐盟、日本等地區(qū)的XML互操作性,,但區(qū)域差異(如模塊1的標(biāo)簽要求)仍需人工適配,。 未來通道創(chuàng) FDA計劃引入API接口支持企業(yè)系統(tǒng)直連,并探索基于云存儲的實時提交與審評,,減少物理媒介依賴,。
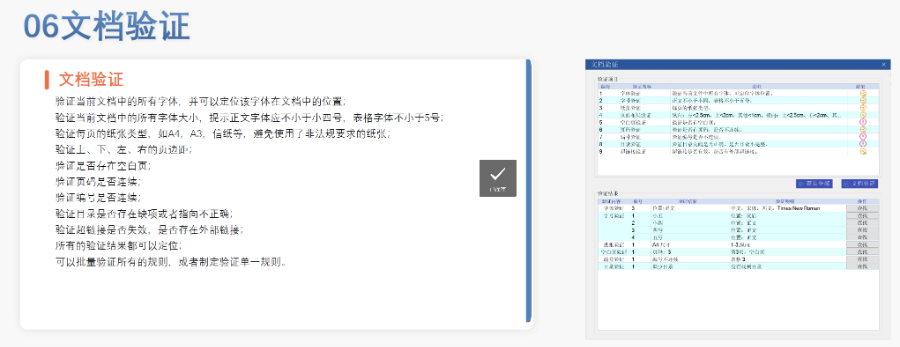
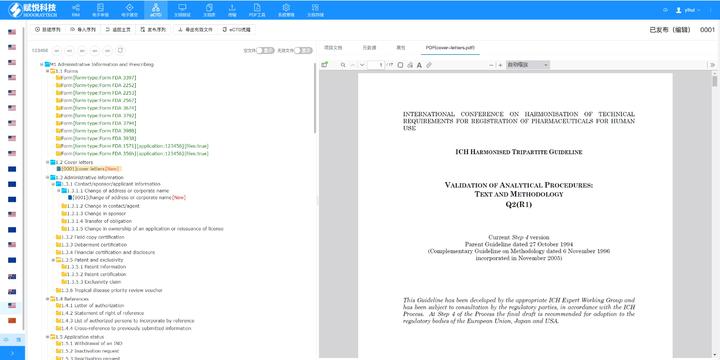
《中國eCTD驗證實踐手冊》作為2025年2月發(fā)布的技術(shù)指南(發(fā)布日期見),為藥品注冊申請人提供了系統(tǒng)化的eCTD申報驗證操作指引,。該手冊基于《中國eCTD驗證標(biāo)準(zhǔn)V1.0》的框架,,重點覆蓋驗證流程中的六大關(guān)鍵領(lǐng)域:基礎(chǔ)識別、文件/文件夾規(guī)范,、ICH骨架文件完整性,、區(qū)域性管理信息校驗、研究標(biāo)簽文件(STF)邏輯性及PDF技術(shù)合規(guī)性,。手冊特別強(qiáng)調(diào)對"錯誤警告提示"三級驗證結(jié)果的差異化處理策略,,指導(dǎo)申請人通過賦悅eCTD軟件進(jìn)行元數(shù)據(jù)填報、STF節(jié)點配置及擴(kuò)展節(jié)點合規(guī)性檢查,,同時針對中國特有的注冊類型差異提出模塊化申報資料準(zhǔn)備方案,。對于PDF文檔,手冊細(xì)化到書簽路徑,、超鏈接屬性及字體嵌入等技術(shù)細(xì)節(jié),,確保電子資料符合CDE審評系統(tǒng)的解析要求。此外,,手冊還結(jié)合生物制品與化學(xué)藥品的申報差異,,明確了3.2.R擴(kuò)展節(jié)點的使用限制,并通過案例解析說明函與申請表生命周期的管理規(guī)則,。美國eCTD申報軟件相關(guān)技術(shù)支持,。
仿制藥作為提高藥物可及性與可負(fù)擔(dān)性的一類藥物,2012年以前,,注冊審評是不收取任何費用的,,但當(dāng)時仿制藥申請積壓嚴(yán)重,從申報到獲批需要3~5年的時間,。 美國國會于2012年頒布了仿制藥使用者費用修正案(Generic Drug User Fee Amendments, GDUFA),,該法律要求制藥行業(yè)支付一定的用戶費用,,以補充仿制藥申請的審評以及現(xiàn)場檢查的費用,減少仿制藥申請積壓,,縮短審評時間,,增加基于風(fēng)險的現(xiàn)場檢查等,其目的是加快公眾獲得安全有效的仿制藥,,并降低行業(yè)成本,。 GDUFA必須每五年重授權(quán)一次,于2017年更(GDUFA II),,于2022年更(GDUFA III); 目前收費種類分為以下四種:ANDA審評費,、DMF審評費,,在審評時一次性繳納;項目費(Program fee),、設(shè)施費(Facility fee),,是上市后每年繳納一次。瑞士eCTD注冊咨詢相關(guān)技術(shù)支持,。安徽國際注冊eCTD報價
eCTD驗證標(biāo)準(zhǔn)相關(guān)技術(shù)支持,。浙江中國eCTD便宜
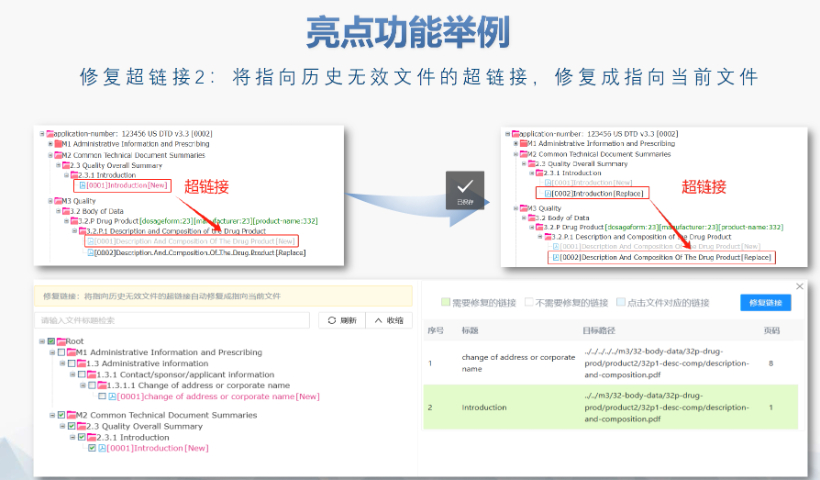
美國eCTD的強(qiáng)制實施時間與范圍:美國自2017年5月5日起要求藥申請(NDA)、仿制藥申請(ANDA)和生物制品許可申請(BLA)必須通過eCTD格式提交,,2018年5月5日進(jìn)一步擴(kuò)展至臨床試驗申請(IND)和藥品主文件(DMF),。FDA通過《聯(lián)邦食品、藥品和化妝品法案》第745A條明確電子提交的強(qiáng)制性,,豁免非商業(yè)化IND和部分DMF類型(如Ⅲ類),。2023年數(shù)據(jù)顯示,F(xiàn)DA接收的eCTD申請占比已達(dá)92%,,標(biāo)志著電子化審評體系的成熟,。企業(yè)若未按規(guī)范提交(如缺少us-regional.xml文件或重復(fù)序列號),將直接被拒收,。浙江中國eCTD便宜