����eCTD�f�� �������� �x���Ƽ�����
�l(f��)؛���c���㽭ʡ������
�l(f��)���r�g��2025-04-23
�l(f��)؛���c���㽭ʡ������
�l(f��)���r�g��2025-04-23
eCTD 4.0�汾���^���c������FDA��2023�ꆢ��eCTD 4.0���gԇ�c,��2024��9����ʽ������Ո,��Ӌ��2029�����ȫ�^�ɡ�4.0�汾����HL7 RPS�˜����XML,��֧���p��ͨ�źͿ���Ո�ļ�����,������ͬһStudy ID����IND��NDA����ģ�K1��У�a��MD5������SHA-256,�������ļ���index.xml�Ğ�submissionunit.xml,������̖ȡ��ǰ���㣨�硰1�����ǡ�0001��������I(y��)��ͬ����ܛ��ϵ�y(t��ng)���m���ܘ�,��DMF�cIND��������Ҫ��ᘌ�Type II��ԭ��ˎ����Type IV���o�ϣ�DMF,��eCTDģ�K3��Ԕ���������a��ˇ����(w��n)���Ԕ�(sh��)��(j��),�����������C����COA��,��FDAҪ��DMF������ָ���������ȴ����ˣ��_����ͨЧ��,����LOA���ڙ����������_���÷���,��IND��ȫ�Ԉ�棨��SUSAR����ͨ�^eCTDģ�K5.3.5�ύ��15������,����Ƕ��CIOMS��MedWatch����,��2024��ָ�Ϗ��{���R����(sh��)��(j��)������SAS XPORT��ʽ�ύ,�����ļ����^4GB���ֲ��f��Ҏ(gu��)�t,����ʿeCTDע����ԃ���P���g֧�֡�����eCTD�f��
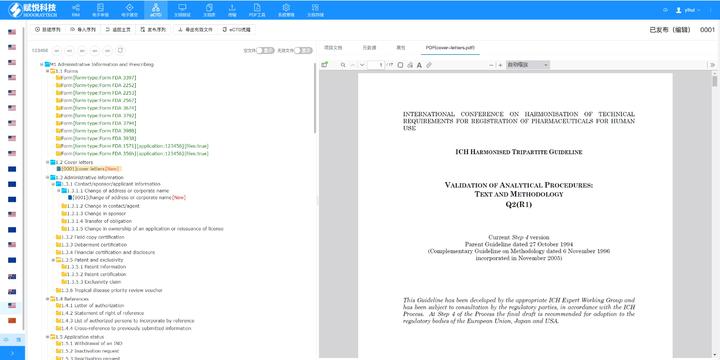
�x��eCTDϵ�y(t��ng) �ļ���C�c�ޏ� ֧���Ԅ���C�ļ���ʽ����PDF����,�����wǶ��,����朽������Եȣ�,����һ�I�ޏͲ����Ϸ�Ҏ(gu��)Ҫ����ļ�������,��ϵ�y(t��ng)���Ԅәz��XML�����ļ��ĽY����Ҏ(gu��)��,���_�������Ї�������,���W�˵ȵ^(q��)��eCTD��Ҏ(gu��)�˜�,�� eCTD�M�b�c�l(f��)�� ���Ԅ����ɷ���CTD�Y��������ęn��������XML�����ļ�,���ļ��A����Ҏ(gu��)��������̖����������Ո?zh��)?����̖�ļ��A�Ԅ����ɣ�,����֧�ֳ�朽Ӻ͕�����������(chu��ng)��������,�������ύ������̖��0000,�����m(x��)ÿ���ύ�Ԅ��f���� �������ڹ��� ֧���ļ�ȫ�������ڲ�������,�����a����Q,���h����,����ͨ�^����̖�B��ֱ�^�@ʾ���¹�(ji��)�ļ�����Ч�ԣ����w�ij����ύ�����,�����е�ȫ���̹���,�� �f(xi��)ͬ�c������ ����B/S�ܘ����g�[��/����������֧���ƶ˻��`���,��ȫ���F�~̖ͨ��,���ṩ���Ñ�f(xi��)�����ܣ��������ּ�,����Ӌۙ,���ļ��汾���Ƶȡ� ��Ҏ(gu��)֧���c���I(y��)���� ���÷����Ї�CDE,������FDA,���W��EMA�ȷ�Ҏ(gu��)��ģ�壬ͬ�r�ṩע����ԃ,���Y����,��eCTD��ʽ���D��ȫ����֧�֣��Fꠓ���17��ˎƷע�Խ��,�����K�x���Ƽ�eCTD�l(f��)��ܛ���W��eCTD���ܛ�����P���g֧��,��
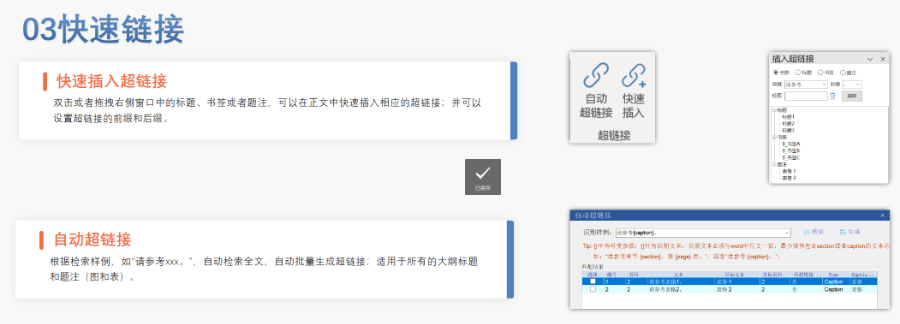
�������ڹ����c׃���f�� eCTD֧��ȫ�������ڹ�������Ո����ͨ�^���и���Sequence����ӳˎƷ׃����Ϣ,������CEP�C���ĸ����ύ��׃���f������,�����������ʺ͔M�ă���,��������ӆ�漼�g�ęn���ش�׃���������a��ˇ�{���������|�l(f��)GMP�F(xi��n)���z��,��EDQM������(j��)�L�U�u���Q���ǷӺ˲�,�� ��Ӻ����c����Ч�� �W�˽��ܷ��ϡ���Ӻ��������Ĕ�(sh��)�ֺ������������Ē������Ƕ��PDF�����ܱ��o,��ģ�K1����Ո���ͳ��Z����횰�����Ч����,����XML�ļ���ͨ�^MD5У�_�������ԡ���ʹ�õ���������,������ǰ��O(ji��n)�ܙC����䲢�@ȡ���g�J��,�� ��С��I(y��)֧���c�YԴ�@ȡ EMA��EDQM����С��I(y��)�ṩeCTD��ʩָ�ϡ���C������Ӗ��ӑ��,������,��EDQM�پW�l(f��)��CEP�f��ģ��Ͱ����죬EMA�t���ڸ�Q&A�ęn�Խ��Ҋ���},������,���W���O����헻����Y����С��I(y��)���eCTD�D�Q��ϵ�y(t��ng)����,��
����ˎ�������ˎ��ɼ����c��ؓ���Ե�һ�ˎ��,��2012����ǰ��ע�Ԍ��u�Dz���ȡ�κ��M�õ�,�������r����ˎ��Ո�e������,������@����Ҫ3~5��ĕr�g�� ����������2012���C���˷���ˎʹ�����M����������Generic Drug User Fee Amendments, GDUFA��,��ԓ����Ҫ����ˎ�ИI(y��)֧��һ�����Ñ��M��,�����a�����ˎ��Ո�Č��u�Լ��F(xi��n)���z����M�ã��p�ٷ���ˎ��Ո�e��,���s�̌��u�r�g,�����ӻ����L�U�ĬF(xi��n)���z��ȣ���Ŀ���Ǽӿ칫���@�ð�ȫ��Ч�ķ���ˎ,���������ИI(y��)�ɱ�,�� GDUFA���ÿ�������ڙ�һ�Σ���2017�����GDUFA II��,����2022�����GDUFA III��,�� Ŀǰ���M�N֞������ķN��ANDA���u�M��DMF���u�M,���ڌ��u�rһ�����U�{,���Ŀ�M��Program fee)���Oʩ�M��Facility fee��,�������к�ÿ���U�{һ��,������ESG����ύͨ����Ո���P���g֧��,��

�ļ��������ڹ�����eCTD֧���ļ���Q��Replace�����h����Delete���Ȳ���,���������ļ�,�����磬���R���о������r����Replace�������w�f�汾,�,������ύ��Baseline Submission���������a��vʷ���|�Y�ϣ������ڷ��溯�����o����׃��,�� �R����(sh��)��(j��)�c�о��˺��ļ���STF����ģ�K4��5�е��о���(sh��)��(j��)��ͨ�^STF��Study Tagging Files������,���_����(sh��)��(j��)�c�ęn�P(li��n)��FDAҪ��(sh��)��(j��)������SAS XPORT��ʽ��������ģ�K3-5,���҆��ļ����^4GB����,��2022��y(t��ng)Ӌ�@ʾ��58%��ANDA���о���(sh��)��(j��)���g�ܽ^�˜ʣ�TRC���e�`����,�� ��Ӻ����c����Ҫ��FDA������356h��1571����ʹ�Ô�(sh��)�ֺ���,��PDF�ļ���ֹ���ܻ��O�þ�����,����Ӻ��������21 CFR Part 11Ҏ(gu��)�����_��������C,�����ɷ��J�Ժ͔�(sh��)��(j��)������,�� ��������cϵ�y(t��ng)��Q�������x���Ƽ���Ӌ�ύ��2000��eCTD��Ո,������ɽ���40%�˹��e�`��,�����ô�ANDAע��������P���g֧�֡����K���Hע��eCTD�t(y��)���Ƽ�
���ô�eCTD���ܛ�����P���g֧��,������eCTD�f��
eCTD�ļ���������ѭ����ķ�Ҏ(gu��)Ҫ��͘˜ʻ�����,���������P�IҪ�c������eCTD����ģ�K���Y��������ģ�K1��������Ϣ����ģ�K5���R����棩,���谴ICH�ͱO(ji��n)�C��Ҫ��Ŀ䛘�,���w�����x���ļ��ύ�Ӽ�����***���r�_�������ã�����ԭ�Ϻ��Ƅ����¹�(ji��)����,�����谴���^���w���Ȳ��,���o�φΪ����¡�PDF�����ӕ���������Ŀ䛣��ͳ�朽ӣ���W����D��,�����^5퓵��ļ���횰���Ŀ䛣�TOC/LOT/LOF��,�����g����(sh��)����ʼҕ�D���O��Ĭ�J�s�ż��e����沼�֣�����չ�_�Ӽ������^����,�����ļ���С��������ϵ�y(t��ng)����,����C���ߣ�ʹ��ܛ������BXeCTD���Ԅ����ɕ����ͳ�朽�,����ͨ�^����У��PDFУ�ܴ_����Ҏ(gu��)�ԡ� ����eCTD�f��