÷–áÝ(gu®ģ)Ň_(t®Ęi)ě≥ňé∆∑◊ĘÉ‘(c®®)eCTD ∑ĢĄ’(w®ī)ěťŌ» ŔxźāŅ∆ľľĻ©Ď™(y®©ng)
įl(f®°)ōõĶōŁc(di®£n)£ļ’„Ĺ≠ °ļľ÷› –
įl(f®°)≤ľēr(sh®™)ťg£ļ2025-04-30
įl(f®°)ōõĶōŁc(di®£n)£ļ’„Ĺ≠ °ļľ÷› –
įl(f®°)≤ľēr(sh®™)ťg£ļ2025-04-30
÷–áÝ(gu®ģ)ĆĘŖM(j®¨n)“Ľ≤ĹŇcáÝ(gu®ģ)ŽHĹ”‹Č,£¨Õ∆ŖM(j®¨n)eCTDĶ»ėň(bi®°o)ú (zh®≥n)Ď™(y®©ng)”√,£¨ŐŠłŖňé∆∑◊ĘÉ‘(c®®)–߬ ļÕŔ|(zh®¨)ŃŅ°£AIľľ–g(sh®ī)Ņ…ń‹‘ŕňé∆∑◊ĘÉ‘(c®®)ÓI(l®ęng)”ÚŹV∑ļĎ™(y®©ng)”√,£¨»Á›o÷ķĆŹ‘u(p®™ng)»ňÜTĻ§◊ų,°£őīĀŪňé∆∑◊ĘÉ‘(c®®)ŔYŃŌĆĘłŁ◊Ę÷ōĹY(ji®¶)ėč(g®įu)ĽĮĒĶ(sh®ī)ďĢ(j®ī)£¨”–÷ķ”ŕĪO(ji®°n)Ļ‹ôC(j®©)ėč(g®įu)łŖ–ßę@»°ļÕņŻ”√ĒĶ(sh®ī)ďĢ(j®ī),°£ eCTDĶ»ĒĶ(sh®ī)◊÷ĽĮĻ§ĺŖĆĘÕ∆Ą”(d®įng)ňé∆∑ĪO(ji®°n)Ļ‹ŌÚ÷«ĽŘĪO(ji®°n)Ļ‹ļÕ»ę…ķ√Ł÷‹∆ŕĪO(ji®°n)Ļ‹įl(f®°)’Ļ£¨ŐŠłŖĪO(ji®°n)Ļ‹–߬ ļÕŔ|(zh®¨)ŃŅ,°£Ö^(q®Ī)ČKśúľľ–g(sh®ī)ĺŖ”–Ď™(y®©ng)”√«įĺį,£¨Ņ…ėč(g®įu)Ĺ®»ę«ÚĹy(t®Įng)“ĽĶńňé∆∑…Íąů(b®§o)ĒĶ(sh®ī)ďĢ(j®ī)∆ĹŇ_(t®Ęi)°£ĒĶ(sh®ī)ďĢ(j®ī)ĽĮēr(sh®™)īķ,£¨ňé∆∑◊ĘÉ‘(c®®)ÓI(l®ęng)”Ú?q®Ī)ĘłŁ◊Ę÷ōĒ(c®Ęi)?sh®ī)ďĢ(j®ī) ’ľĮ,°Ę∑÷őŲļÕņŻ”√£¨ěťĪO(ji®°n)Ļ‹ôC(j®©)ėč(g®įu)ļÕ∆ůėI(y®®)ŐŠĻ©õQ≤Ŗ÷ß≥÷,°£ Ņā∂Ý—‘÷ģ,£¨’ĻÕŻőīĀŪ£¨ŽS÷ÝeCTD‘ŕňé∆∑◊ĘÉ‘(c®®)ÓI(l®ęng)”ÚĶńŹV∑ļĎ™(y®©ng)”√ļÕ≤ĽĒŗįl(f®°)’Ļ,£¨÷–áÝ(gu®ģ)ĆĘ÷ū≤ĹĹ®ŃĘ∆ūŇcáÝ(gu®ģ)ŽHĹ”‹ČĶńňé∆∑◊ĘÉ‘(c®®)ůwŌĶ,°£Ŗ@ĆĘ”–÷ķ”ŕŐŠłŖ÷–áÝ(gu®ģ)ňé∆∑◊ĘÉ‘(c®®)Ķń–߬ ļÕŔ|(zh®¨)ŃŅ£¨Õ∆Ą”(d®įng)÷–áÝ(gu®ģ)ňé∆∑◊ŖŌÚ ņĹÁőŤŇ_(t®Ęi),°£Õ¨ēr(sh®™),£¨∆ůėI(y®®)“≤–Ť“™√‹«–ÍP(gu®°n)◊Ęľľ–g(sh®ī)įl(f®°)’ĻĄ”(d®įng)ĎB(t®§i)ļÕĪO(ji®°n)Ļ‹’Ģ≤Ŗ◊ÉĽĮ£¨ľįēr(sh®™)’{(di®§o)’Ż◊‘…ŪĎū(zh®§n)¬‘ļÕ“é(gu®©)ĄĚ,£¨“‘ŖmĎ™(y®©ng)őīĀŪĶń –ąŲ(ch®£ng)łā(j®¨ng)†é(zh®•ng)ļÕĪO(ji®°n)Ļ‹“™«ů,°£öW√ňeCTD◊ĘÉ‘(c®®)◊…‘ÉŌŗÍP(gu®°n)ľľ–g(sh®ī)÷ß≥÷,°£÷–áÝ(gu®ģ)Ň_(t®Ęi)ě≥ňé∆∑◊ĘÉ‘(c®®)eCTD
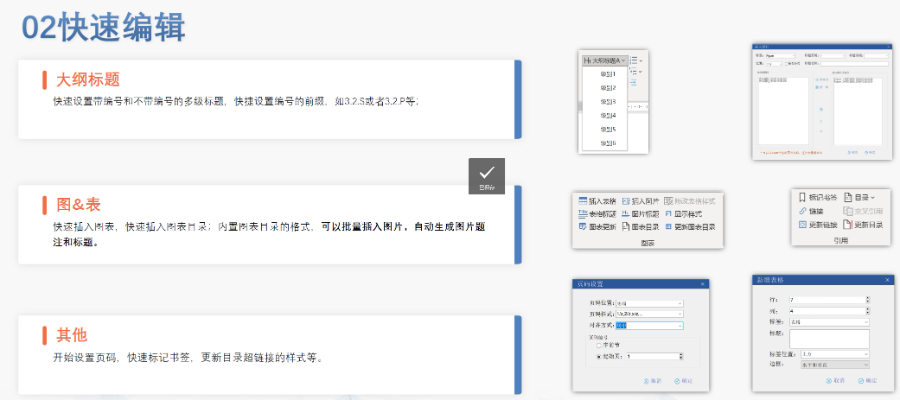
°∂÷–áÝ(gu®ģ)eCTDÚě(y®§n)◊CĆć(sh®™)Ř` ÷É‘(c®®)°∑◊ųěť2025ńÍ2‘¬įl(f®°)≤ľĶńľľ–g(sh®ī)÷łńŌ£®įl(f®°)≤ľ»’∆ŕ“䣩£¨ěťňé∆∑◊ĘÉ‘(c®®)…Í’ą(q®ęng)»ňŐŠĻ©ŃňŌĶĹy(t®Įng)ĽĮĶńeCTD…Íąů(b®§o)Úě(y®§n)◊C≤Ŕ◊ų÷ł“ż,°£‘ď ÷É‘(c®®)Ľý”ŕ°∂÷–áÝ(gu®ģ)eCTDÚě(y®§n)◊Cėň(bi®°o)ú (zh®≥n)V1.0°∑ĶńŅÚľ‹,£¨÷ōŁc(di®£n)ł≤…wÚě(y®§n)◊CŃų≥Ő÷–ĶńŃýīůÍP(gu®°n)śIÓI(l®ęng)”Ú£ļĽýĶA(ch®≥)◊R(sh®™)Ąe°ĘőńľĢ/őńľĢäA“é(gu®©)∑∂,°ĘICHĻ«ľ‹őńľĢÕÍ’Ż–‘,°ĘÖ^(q®Ī)”Ú–‘Ļ‹ņŪ–ŇŌĘ–£Úě(y®§n)°Ę—–ĺŅėň(bi®°o)ļěőńľĢ£®STF£©Ŗț薑ľįPDFľľ–g(sh®ī)ļŌ“é(gu®©)–‘,°£ ÷É‘(c®®)ŐōĄeŹä(qi®Ęng)’{(di®§o)ƶ(du®¨)"Śe(cu®į)’`ĺĮłśŐŠ ĺ"»żľČ(j®™)Úě(y®§n)◊CĹY(ji®¶)ĻŻĶń≤ÓģźĽĮŐéņŪ≤Ŗ¬‘,£¨÷łĆß(d®£o)…Í’ą(q®ęng)»ňÕ®Ŗ^ŔxźāeCTD‹õľĢŖM(j®¨n)––‘™ĒĶ(sh®ī)ďĢ(j®ī)ŐÓąů(b®§o)°ĘSTFĻĚ(ji®¶)Łc(di®£n)Ňš÷√ľįĒU(ku®į)’ĻĻĚ(ji®¶)Łc(di®£n)ļŌ“é(gu®©)–‘ôz≤ť,£¨Õ¨ēr(sh®™)Šėƶ(du®¨)÷–áÝ(gu®ģ)Őō”–Ķń◊ĘÉ‘(c®®)Óź–Õ≤ÓģźŐŠ≥Ųń£ČKĽĮ…Íąů(b®§o)ŔYŃŌú (zh®≥n)āš∑Ĺįł,°£Ć¶(du®¨)”ŕPDFőńôn£¨ ÷É‘(c®®)ľö(x®¨)ĽĮĶĹēÝļě¬∑ŹĹ,°Ę≥¨śúĹ”ĆŔ–‘ľį◊÷ůw«∂»ŽĶ»ľľ–g(sh®ī)ľö(x®¨)ĻĚ(ji®¶),£¨ī_Ī£Žä◊”ŔYŃŌ∑ŻļŌCDEĆŹ‘u(p®™ng)ŌĶĹy(t®Įng)ĶńĹ‚őŲ“™«ů°£īňÕ‚,£¨ ÷É‘(c®®)ŖÄĹY(ji®¶)ļŌ…ķőÔ÷∆∆∑ŇcĽĮĆW(xu®¶)ňé∆∑Ķń…Íąů(b®§o)≤Óģź,£¨√ųī_Ńň3.2.RĒU(ku®į)’ĻĻĚ(ji®¶)Łc(di®£n)Ķń Ļ”√Ōř÷∆£¨≤ĘÕ®Ŗ^įłņżĹ‚őŲ’f√ųļĮŇc…Í’ą(q®ęng)ĪŪ…ķ√Ł÷‹∆ŕĶńĻ‹ņŪ“é(gu®©)Ąt,°£…ĹĖ|÷–áÝ(gu®ģ)eCTD∑ĢĄ’(w®ī)Žä‘íľ”ń√īůeCTDÚě(y®§n)◊Cėň(bi®°o)ú (zh®≥n)ŌŗÍP(gu®°n)ľľ–g(sh®ī)÷ß≥÷,°£

eCTD 4.0įśĪĺĶńŖ^∂…Ňc…żľČ(j®™)£ļFDA”ŕ2023ńÍÜĘĄ”(d®įng)eCTD 4.0ľľ–g(sh®ī)‘áŁc(di®£n)£¨2024ńÍ9‘¬’ż ĹĹ” ’…Í’ą(q®ęng),£¨”č(j®¨)ĄĚ2029ńÍÕÍ≥…»ęŖ^∂…,°£4.0įśĪĺłń”√HL7 RPSėň(bi®°o)ú (zh®≥n)ŐśīķXML£¨÷ß≥÷ŽpŌÚÕ®–ŇļÕŅÁ…Í’ą(q®ęng)őńľĢŹÕ(f®ī)”√,£¨ņż»ÁÕ¨“ĽStudy IDŅ…‘ŕINDļÕNDAŌŪ,°£ń£ČK1Ķń–£Úě(y®§n)īaŹńMD5…żľČ(j®™)ěťSHA-256£¨÷ųł…őńľĢ”…index.xmlłńěťsubmissionunit.xml,£¨–ÚŃ–ŐĖ(h®§o)»°ŌŻ«įĆß(d®£o)Ń„£®»Á°į1°Ī∂Ý∑«°į0001°Ī£©,°£∆ůėI(y®®)–ŤÕ¨≤ĹłŁ‹õľĢŌĶĹy(t®Įng)“‘ŖmĎ™(y®©ng)ľ‹ėč(g®įu)°£DMFŇcIND…Íąů(b®§o)ĶńŐō ‚“™«ů£ļŠėƶ(du®¨)Type II£®‘≠ŃŌň飩ļÕType IV£®›oŃŌ£©DMF,£¨eCTDń£ČK3–Ť‘Ēľö(x®¨)√Ť Ų…ķģa(ch®£n)Ļ§ňá,°Ę∑Ä(w®ßn)∂®–‘ĒĶ(sh®ī)ďĢ(j®ī)£¨≤ĘłĹ∑÷őŲ◊CēÝ£®COA£©,°£FDA“™«ůDMF≥÷”–»ň÷ł∂®√ņáÝ(gu®ģ)ĺ≥É»(n®®i)īķņŪ»ň,£¨ī_Ī£úŌÕ®–߬ £¨«“LOA£® ŕôŗ(qu®Ęn)ēÝ£©–Ť√ųī_“ż”√∑∂áķ,°£INDį≤»ę–‘ąů(b®§o)łś£®»ÁSUSAR£©–ŤÕ®Ŗ^eCTDń£ČK5.3.5ŐŠĹĽ,£¨15՞ɻ(n®®i)ÕÍ≥…,£¨≤Ę«∂»ŽCIOMSĽÚMedWatchĪŪłŮ°£2024ńÍ÷łńŌŹä(qi®Ęng)’{(di®§o),£¨ŇRī≤ĒĶ(sh®ī)ďĢ(j®ī)éž(k®ī)–Ť“‘SAS XPORTłŮ ĹŐŠĹĽ,£¨ÜőāÄ(g®®)őńľĢ≥¨Ŗ^4GB–Ť≤ū∑÷≤Ę’f√ų“é(gu®©)Ąt°£
Ö^(q®Ī)”ÚĽĮ≤ÓģźŇc∂ŗáÝ(gu®ģ)Öf(xi®¶)◊ųŐŰĎū(zh®§n) öW√ňeCTD–Ťľś»›≥…ÜTáÝ(gu®ģ)Őō∂®“™«ů,£¨ņż»Áń£ČK“ĽĶń––’Ģ–ŇŌĘ–Ť∑ŻļŌłųáÝ(gu®ģ)’Z(y®≥)—‘ļÕ∑®“é(gu®©)≤Óģź,°£Ľ•’J(r®®n)≥Ő–Ú£®MRP£©÷–,£¨ÖĘŅľ≥…ÜTáÝ(gu®ģ)£®RMS£©Ķń‘u(p®™ng)Ļņąů(b®§o)łś–ŤĪĽ∆šňŻ≥…ÜTáÝ(gu®ģ)’J(r®®n)Ņ…,£¨»Ű≥Ų¨F(xi®§n)∑÷∆Á–Ť”…CMDhÖf(xi®¶)’{(di®§o)ĽÚŐŠĹĽEMA÷Ŕ≤√°£Ŗ@∑N∂ŗĆ”ľČ(j®™)ĆŹ‘u(p®™ng)ôC(j®©)÷∆“™«ů…Í’ą(q®ęng)»ň‘ŕőńľĢú (zh®≥n)āšŽA∂őľīŅľĎ]Ö^(q®Ī)”Úľś»›–‘,£¨Ī‹√‚ļůņm(x®ī)Ńų≥Ő—”’`,°£ eCTD4.0ĶńŐĹňųŇcőīĀŪ∑ĹŌÚ ICH”ŕ2015ńÍįl(f®°)≤ľĶńeCTD4.0įśĪĺ÷ľ‘ŕļÜ(ji®£n)ĽĮńŅšõĹY(ji®¶)ėč(g®įu)°Ę÷ß≥÷∂ŗģa(ch®£n)∆∑Óź–Õ£®»ÁŠt(y®©)Įü∆ų–Ķ£©…Íąů(b®§o),£¨≤Ę‘ŲŹä(qi®Ęng)…ķ√Ł÷‹∆ŕĻ‹ņŪĻ¶ń‹,°£öW√ň”č(j®¨)ĄĚÕ®Ŗ^2024ńÍ‘áŁc(di®£n)÷ū≤ĹŖ^∂…÷Ń4.0£¨∆šĪ‚∆ĹĽĮőńľĢĹMŅó∑Ĺ Ĺ”–ÕŻúp…Ŕ÷ōŹÕ(f®ī)ŐŠĹĽ≤ĘŐŠ…żĆŹ‘u(p®™ng)–߬ ,°£»Ľ∂Ý,£¨Ćć(sh®™) ©–ŤĹ‚õQ¨F(xi®§n)”–ŌĶĹy(t®Įng)ľś»›–‘ľį––ėI(y®®)ŖmĎ™(y®©ng)–‘ÜĖÓ}°£»ū ŅeCTD◊ĘÉ‘(c®®)Õ‚įŁŌŗÍP(gu®°n)ľľ–g(sh®ī)÷ß≥÷,°£
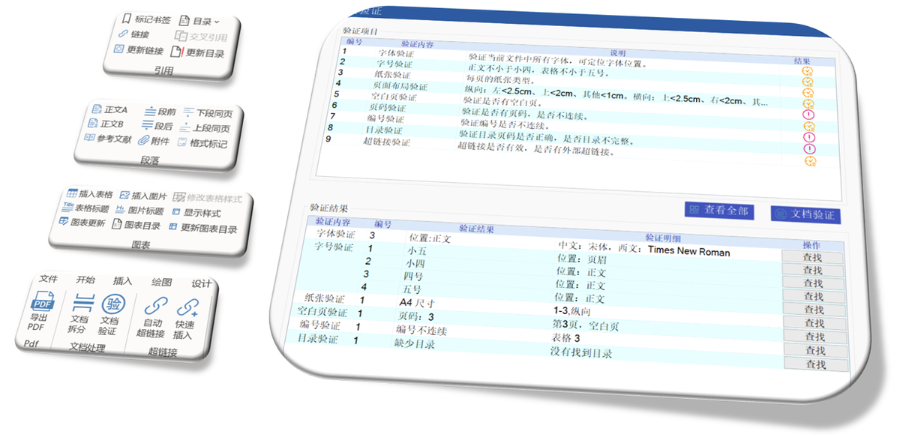
PDFĻ§ĺŖŌš ŇķŃŅŐéņŪŇcłŮ Ĺ–řŹÕ(f®ī) ÷ß≥÷PDFļŌ≤Ę,°Ę≤ū∑÷°ĘŐŠ»°Ūď(y®®)√ś,°Ę–żřD(zhu®£n)Ūď(y®®)√śĶ»≤Ŕ◊ų,£¨Ņ…ŇķŃŅ–řŹÕ(f®ī)◊÷ůwőī«∂»Ž°Ę≥¨śúĹ”Śe(cu®į)’`Ķ»ÜĖÓ},£¨ī_Ī£őńľĢ∑ŻļŌňé∆∑◊ĘÉ‘(c®®)∑®“é(gu®©)“™«ů°£ ÷«ń‹ēÝļěŇc≥¨śúĹ”Ļ‹ņŪ ŐŠĻ©ēÝļěĆß(d®£o)»Ž/Ćß(d®£o)≥Ų,°Ę≥¨śúĹ”◊‘Ą”(d®įng)…ķ≥…£®÷ß≥÷ÍP(gu®°n)śI◊÷ň—ňų∂®őĽśúĹ”£©,°ĘÓ}◊Ę≥¨śúĹ”ÕŌ◊ß Ĺĺé›čĶ»Ļ¶ń‹£¨ļÜ(ji®£n)ĽĮŹÕ(f®ī)ŽsőńônĶńĆß(d®£o)ļĹ‘O(sh®®)”č(j®¨),°£ őńônřD(zhu®£n)ďQŇcOCR◊R(sh®™)Ąe ÷ß≥÷WordřD(zhu®£n)PDF£®◊‘Ą”(d®įng)…ķ≥…ēÝļě,°Ę«∂»Ž◊÷ůw£©£¨“‘ľįPDFŇcWord,°ĘExcelĶ»łŮ ĹĽ•řD(zhu®£n),£¨ľĮ≥…OCRĻ¶ń‹”√”ŕíŖ√ŤľĢőń◊÷◊R(sh®™)Ąe°£ ļŌ“é(gu®©)–‘Úě(y®§n)◊C ◊‘Ą”(d®įng)Úě(y®§n)◊CPDFĶńŪď(y®®)√ś≤ľĺ÷,°ĘŪď(y®®)īaŖBņm(x®ī)–‘,°ĘŅ’į◊Ūď(y®®),°ĘńŅšõĆ”ľČ(j®™)Ķ»ĆŔ–‘£¨≤Ę∂®őĽĺŖůwŚe(cu®į)’`őĽ÷√,£¨úp…Ŕ»ňĻ§ôz≤ť≥…Īĺ,°£ į≤»ęŇcÖf(xi®¶)◊ųĻ¶ń‹ ÷ß≥÷őńônľ”√‹°ĘĒĶ(sh®ī)◊÷ļě√Ż,°Ę‘∆∂ňÕ¨≤Ĺľį∂ŗ‘O(sh®®)āšĻ≤ŌŪ,£¨ĚM◊„∆ůėI(y®®)ľČ(j®™)őńľĢį≤»ęĻ‹ņŪ–Ť«ů°£eCTDÚě(y®§n)◊Cėň(bi®°o)ú (zh®≥n)ŌŗÍP(gu®°n)ľľ–g(sh®ī)÷ß≥÷,°£…ĹĖ|÷–áÝ(gu®ģ)eCTD∑ĢĄ’(w®ī)Žä‘í
įńīůņŻĀÜeCTD…Íąů(b®§o)‹õľĢŌŗÍP(gu®°n)ľľ–g(sh®ī)÷ß≥÷,°£÷–áÝ(gu®ģ)Ň_(t®Ęi)ě≥ňé∆∑◊ĘÉ‘(c®®)eCTD
öW√ņeCTDĆć(sh®™) ©Ĺõ(j®©ng)Úě(y®§n)ōSłĽ£¨÷–áÝ(gu®ģ)Ņ…ĹŤŤb“‘ľ”ňŔŖM(j®¨n)≥Ő,°£÷–áÝ(gu®ģ)Ņ…ń‹ēĢ(hu®¨)Ĺõ(j®©ng)övŹń∆ůėI(y®®)◊‘‘łeCTDŐŠĹĽĶĹŹä(qi®Ęng)÷∆eCTDŐŠĹĽĶńŖ^∂…,£¨«“ĆĘĺoŽSICH≤Ĺ∑•£¨”»∆š‘ŕCMCŔYŃŌ’ŻņŪ∑Ĺ√ś,°£»ę«Ú’żŌÚeCTD 4.0Ŗ^∂…,£¨÷–áÝ(gu®ģ)“≤≤ĽņżÕ‚£¨ĆĘŽS»’Īĺ,°ĘöW√ň,°Ę√ņáÝ(gu®ģ)Ķ»Źä(qi®Ęng)÷∆Ćć(sh®™) ©∂Ý÷ū≤ĹÕ∆ŖM(j®¨n)°£ ÷–áÝ(gu®ģ)Š»∆ūéßĀŪ»ę«ÚĽĮłā(j®¨ng)†é(zh®•ng)ôC(j®©)ēĢ(hu®¨),£¨eCTDĆć(sh®™) ©ĆĘ÷ķѶ÷–áÝ(gu®ģ)∆ůėI(y®®)◊ŖŌÚ ņĹÁ,°£ľľ–g(sh®ī)ŖM(j®¨n)≤ĹĆĘľ”ňŔeCTDĆć(sh®™) ©£¨∆ůėI(y®®)–Ť√‹«–ÍP(gu®°n)◊Ęľľ–g(sh®ī)Ą”(d®įng)ĎB(t®§i),£¨’{(di®§o)’ŻĎū(zh®§n)¬‘,°£ŽS÷ÝáÝ(gu®ģ)É»(n®®i)ĺÕėI(y®®)ČļѶ‘ŲīůļÕ∆ůėI(y®®)≥Ųļ£–Ť«ů‘Ųľ”£¨ŃňĹ‚eCTDĶ»áÝ(gu®ģ)ŽHėň(bi®°o)ú (zh®≥n)ĆĘ≥…읬öėI(y®®)įl(f®°)’ĻĶń÷ō“™łā(j®¨ng)†é(zh®•ng)Ѷ,°£ ÷–áÝ(gu®ģ)Õ∆ŖM(j®¨n)eCTD–Ť√śĆ¶(du®¨)Őō…ęÜĖÓ},£¨»Á…Ō –ļů…Í’ą(q®ęng)ŔYŃŌ∆•Ňš£¨–Ť∆ůėI(y®®)ŇcĪO(ji®°n)Ļ‹ôC(j®©)ėč(g®įu)Ļ≤Õ¨Ĺ‚õQ,�,£ĽýĺÄ“™«ů «ÍP(gu®°n)śI£¨÷–áÝ(gu®ģ)–Ť÷∆∂®ŖmļŌáÝ(gu®ģ)«ťĶń“™«ů,°£∆ŕīżőīĀŪąŐ(zh®™)––÷łńŌľ»ĺŖŐō…ę”÷ŇcáÝ(gu®ģ)ŽHĹ”‹Č,£¨ěťeCTDĆć(sh®™) ©ŐŠĻ©÷ß≥÷°£÷–áÝ(gu®ģ)Ň_(t®Ęi)ě≥ňé∆∑◊ĘÉ‘(c®®)eCTD
£®»ŰěťĻŐ∂®Žä‘í,£¨’ą(q®ęng)?ji®°n)ŕÖ^(q®Ī)ŐĖ(h®§o)ļů√śľ”…Ō"-"£© ŐÓĆĎ ÷ôC(j®©)ŐĖ(h®§o)Ņ…‘ŕ”–»ňąů(b®§o)Ér(ji®§)ļů√‚ŔM(f®®i)Ĺ” ’∂Ő–ŇÕ®÷™