�Ϻ����Hע��eCTD��ʽ ����(w��)���� �x���Ƽ�����(y��ng)
�l(f��)؛���c���㽭ʡ������
�l(f��)���r�g��2025-07-05
�l(f��)؛���c���㽭ʡ������
�l(f��)���r�g��2025-07-05
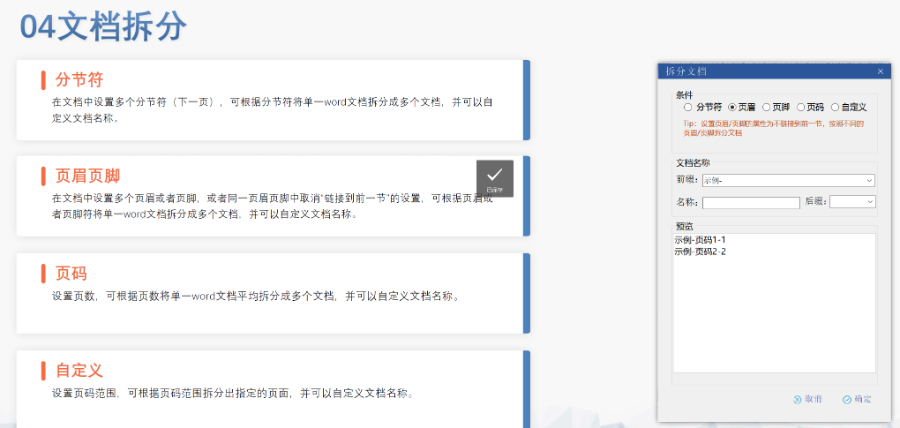
eCTD�ļ���������ѭ��(y��n)��ķ�Ҏ(gu��)Ҫ��͘�(bi��o)��(zh��n)������,���������P(gu��n)�IҪ�c������eCTD����ģ�K���Y(ji��)��(g��u),������ģ�K1��������Ϣ����ģ�K5���R����棩���谴ICH�ͱO(ji��n)�C(j��)��(g��u)Ҫ��(g��u)��Ŀ䛘�,���w�����x���ļ��ύ�Ӽ�����***���r�_��������,������ԭ�Ϻ��Ƅ����¹�(ji��)���硢���谴���^���w���Ȳ��,���o�φΪ�����,��PDF�����ӕ�������(d��o)��Ŀ䛣��ͳ�朽ӣ���W(w��ng)����D(zhu��n)�������^5퓵��ļ���횰���Ŀ䛣�TOC/LOT/LOF��,�����g(sh��)����(sh��)����ʼҕ�D���O(sh��)��Ĭ�J(r��n)�s�ż��e����沼��,������չ�_�Ӽ������^���������ļ���С��������ϵ�y(t��ng)����,����C���ߣ�ʹ��ܛ������BXeCTD���Ԅ����ɕ����ͳ�朽�,����ͨ�^����У��PDFУ�ܴ_����Ҏ(gu��)�ԡ� �W��CESP�ύͨ�����P(gu��n)���g(sh��)֧��,���Ϻ����Hע��eCTD��ʽ

��(j��ng)��(j��)Ӱ��c�ɱ�Ч�� �M�ܳ���Ͷ���^�ߣ�ƽ��ÿ��I(y��)��50�f�WԪ��,����eCTD�ɜp��30%�Č��u���t�ɱ����L��Ч��,������ˎ��I(y��)ͨ�^eCTD��(f��)��ԭ�Д�(sh��)��(j��),����(ji��)ʡ80%������(zh��n)��r�g���W���A(y��)��ܿ�2�|�WԪ�Y����С��I(y��)��ɔ�(sh��)�ֻ��D(zhu��n)��,�� ���팏���c��(sh��)��(j��)�[˽ eCTD�еĻ��ߔ�(sh��)��(j��)��������̎��,�����ϡ�ͨ�Ô�(sh��)��(j��)���o(h��)�l������GDPR��Ҫ���R��ԇ�?z��i)��K��ģ�K5�����ύ�踽������ί�T������(zh��n)�ļ�,���҅^(q��)��汾���w�F(xi��n)�������팏��,��AI�o�������������ڱ��o(h��)�[˽��ͬ�r������(sh��)��(j��)̎��Ч�ʡ� ���g(sh��)�ں��c���I(l��ng)��(y��ng)�� eCTD��ʽ�U(ku��)չ���t(y��)����е�ͱ���Ʒ�I(l��ng)��,���W��ԇ�ceCTD-MDR�Ŀ����ISO��(bi��o)��(zh��n),������a(ch��n)Ʒ��eCTD�踽�����ﰲȫ��(sh��)��(j��)��,�����c�W�˻���쌍�rͬ��,��δ����eCTD���c��ӽ����n����EHR��ϵ�y(t��ng)����,��֧�ւ��Ի���ˎ,�� ���m(x��)���M(j��n)�c�ИI(y��)�����C(j��)�� EMAÿ��l(f��)��eCTD��ʩ��棬������Ҋ�e�`����ָ��,���ИI(y��)(li��n)�ˣ���EFPIA��ͨ�^������ӑ����O(ji��n)�ܙC(j��)��(g��u)�������g(sh��)ʹ�c,���ƄӘ�(bi��o)��(zh��n)��(y��u)��,���_��ʽAPI�ӿڵ��ƏV�����M(j��n)eCTD����朵Ļ������ԣ����ͼ��g(sh��)�i���L(f��ng)�U,������CDE eCTD��r����ESG����ύͨ����Ո���P(gu��n)���g(sh��)֧��,��
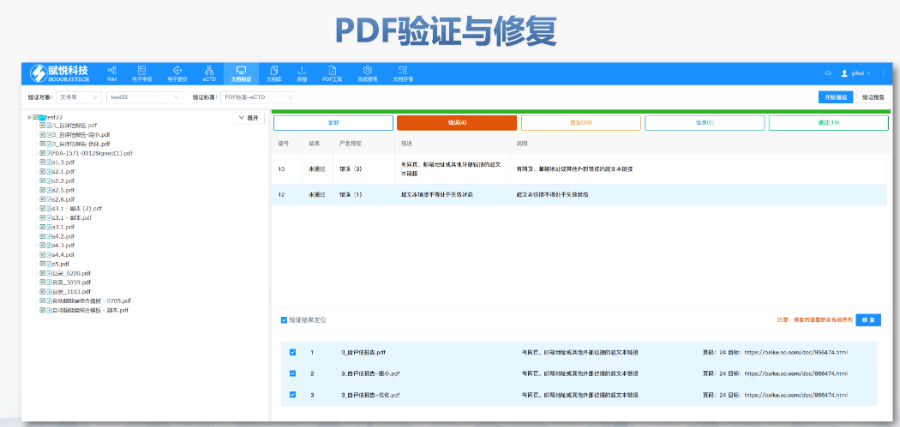
�ļ��������ڹ�����eCTD֧���ļ���Q��Replace�����h����Delete���Ȳ���,���������ļ�,�����磬���R���о������r����Replace�������w�f�汾,�,������ύ��BaselineSubmission���������a��vʷ���|(zh��)�Y�ϣ������ڷ��溯�����o��(n��i)��׃��,���R����(sh��)��(j��)�c�о���(bi��o)���ļ���STF����ģ�K4��5�е��о���(sh��)��(j��)��ͨ�^STF��StudyTaggingFiles������,���_����(sh��)��(j��)�c�ęn�P(gu��n)(li��n)��FDAҪ��(sh��)��(j��)������SASXPORT��ʽ��������ģ�K3-5,���҆��ļ����^4GB����,��2022��y(t��ng)Ӌ�@ʾ��58%��ANDA���о���(sh��)��(j��)���g(sh��)�ܽ^��(bi��o)��(zh��n)��TRC���e�`����,����Ӻ����c����Ҫ��FDA������356h��1571����ʹ�Ô�(sh��)�ֺ���,��PDF�ļ���ֹ���ܻ��O(sh��)�þ�����,����Ӻ��������21CFRPart11Ҏ(gu��)�����_��������C,�����ɷ��J(r��n)�Ժ͔�(sh��)��(j��)������,���������(w��)�cϵ�y(t��ng)��Q�������x���Ƽ���Ӌ�ύ��2000��eCTD��Ո������ɽ���40%�˹��e�`��,��
��������cҪ�� �Y�Ϝ�(zh��n)�� ��(n��i)��Ҫ�����a(ch��n)Ʒ����,�����a(ch��n)��ˇ��ԭ���ρ�Դ���O(sh��)�䅢��(sh��)�ȣ�,���|(zh��)�����Ƙ�(bi��o)��(zh��n)��SOP,����(w��n)���Ԕ�(sh��)��(j��)������ȫ���c�����о���,�� ��ʽҎ(gu��)���� ����CTD��ͨ�ü��g(sh��)�ļ�����ʽ,����ģ�K���¹�(ji��)����ģ�K3��CMC��(sh��)��(j��)���� ����ύ�����eCTD��(bi��o)��(zh��n)���ļ�С��10GBͨ�^ESGϵ�y(t��ng)�ύ,�����^���x��CD-ROM��,�� �ύ�cע�� �A(y��)����DMF̖�������ύǰ��Ո���_���ļ��c��̖����,�� �ڙ�(qu��n)����LOA������������DMF���Ƅ��S���ṩ�ڙ�(qu��n)��,�����_�ɲ�醵��¹�(ji��),�� �M�ã����ԭ��ˎDMF���U�{���M��2024��s9,468��Ԫ���� FDA�������� �������u��2-3�܃�(n��i)�_�J(r��n)�ļ�������,�� �����Ԍ��u��CA����ᘌ����DMF,���s60�졣 ���g(sh��)���u����DMF���Ƅ���Ո����ANDA,��NDA�����Õr����,������60-180�졣 �Y(ji��)��������FDA����Ҫ���a�䔵(sh��)��(j��),����DMF����o������(zh��n)����B(t��i),��ͨ�^������յ����o�M(j��n)һ����Ҋ������No Further Comment Letter�������ô�ANDAע��������P(gu��n)���g(sh��)֧��,��
�ļ��|(zh��)����ӵĚvʷ�^�� 2017��ǰ,���������S���|(zh��)�ceCTD�����ύ�����˺�����̭���|(zh��)ͨ��,�������o����r�µ����⌏��,��2020����ӻ�������IND,��NDA,��ANDA��DMF��(qi��ng)�Ʋ���eCTD��ʽ�� ϵ�y(t��ng)ƽ�_���� FDAͨ�^��ˎƷ�I(y��)��(w��)��(y��ng)��ϵ�y(t��ng)���͡�ˎƷeCTDע��ϵ�y(t��ng)�����F(xi��n)����Y�Ͻ���,�������c���u��ȫ���̔�(sh��)�ֻ�,��2022��ϵ�y(t��ng)���Ԅ����������ĕ��Ͷ������ѹ��ܣ��p���˹����A(y��),�� ����ęn�Y(ji��)��(g��u)��(y��u)�� ����eCTD���÷��ļ��A�Y(ji��)��(g��u),�����绯�W(xu��)ˎƷ��ģ�K1-5�քe����(y��ng)�����ļ������Y(ji��)���,���|(zh��)����(sh��)��(j��)��,��2020��������R��ԇ(sh��)��(j��)�족�b��Ҫ��(qi��ng)����(sh��)��(j��)������,���W��eCTDע����ԃ���P(gu��n)���g(sh��)֧��,������eCTD��ʲô
eCTD��C���`�փ����P(gu��n)���g(sh��)֧�֡��Ϻ����Hע��eCTD��ʽ
eCTD��C��(bi��o)��(zh��n)�ć�(y��n)�����c����W�ˌ�eCTD����CҪ��֞顰�e�`�������桱�͡���ʾ��Ϣ������,�����С��e�`���ֱ�ӌ�(d��o)�����,����C�Ŀ���w�����149�l�������ļ�����Ҏ(gu��)������·���L�����ƣ�,��PDF���x�ԣ���ֹ�ܴa���o(h��)��,��XML�Ǽ��ļ������Եȡ����磬�ļ��U(ku��)չ����횷���Ҏ(gu��)������.xpt�����R����(sh��)��(j��)����,�����ļ��A�Ӽ�������Ŀ䛻��ϴ���ļ�,�����^���Ї�����������C��(bi��o)��(zh��n)���ĺ����棨54�l�����W�˵���C�wϵ�����(f��)�s,���w�F(xi��n)����ߘ�(bi��o)��(zh��n)�ļ��g(sh��)�O(ji��n)��,���Ϻ����Hע��eCTD��ʽ