法規(guī)文檔管理系統(tǒng) 協(xié)同共享 RDMS可以讓跨區(qū)域、跨部門協(xié)同真正成為1+1>2的 工作,。讓頻繁的文檔共享傳輸,,版本管理,,生命周 期審批都變得輕松簡單 安全合規(guī) 通過詳細的審計追蹤、電子簽名,、權(quán)限管理,、網(wǎng) 關(guān)控制、頁面控制等技術(shù)手段,,構(gòu)建安全合規(guī)的 文檔管理系統(tǒng),,通過安全驗證與合規(guī)驗證 統(tǒng)一文檔來源 藥品注冊是企業(yè)經(jīng)營成果的技術(shù)資料,由多個部門 長時間匯集到法規(guī)部門,。RDMS確保多部門文檔來 源統(tǒng)一,,即使人員流動也可以快速接續(xù)工作 統(tǒng)一文檔結(jié)構(gòu) 根據(jù)不同申報類型,自動生成文檔結(jié)構(gòu),,讓法規(guī) 人員與跨部門同事掌握申報需要的資料需求,,降 低溝通成本,降低經(jīng)驗需求,,避免疏忽遺漏美國ANDA注冊申報相關(guān)技術(shù)支持,。浙江賦悅科技eCTD銷售電話
區(qū)域化差異與多國協(xié)作挑戰(zhàn) 歐盟eCTD需兼容成員國特定要求,例如模塊一的行政信息需符合各國語言和法規(guī)差異,�,;フJ程序(MRP)中,參考成員國(RMS)的評估報告需被其他成員國認可,,若出現(xiàn)分歧需由CMDh協(xié)調(diào)或提交EMA仲裁,。這種多層級審評機制要求申請人在文件準備階段即考慮區(qū)域兼容性,避免后續(xù)流程延誤,。 eCTD4.0的探索與未來方向 ICH于2015年發(fā)布的eCTD4.0版本旨在簡化目錄結(jié)構(gòu),、支持多產(chǎn)品類型(如醫(yī)療器械)申報,并增強生命周期管理功能,。歐盟計劃通過2024年試點逐步過渡至4.0,,其扁平化文件組織方式有望減少重復(fù)提交并提升審評效率。然而,,實施需解決現(xiàn)有系統(tǒng)兼容性及行業(yè)適應(yīng)性問題,。浙江賦悅科技eCTD銷售電話澳大利亞DMF注冊申報相關(guān)技術(shù)支持。
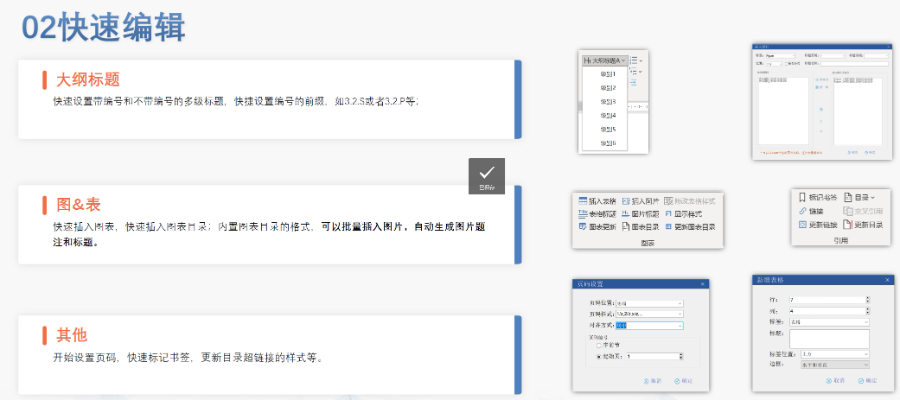
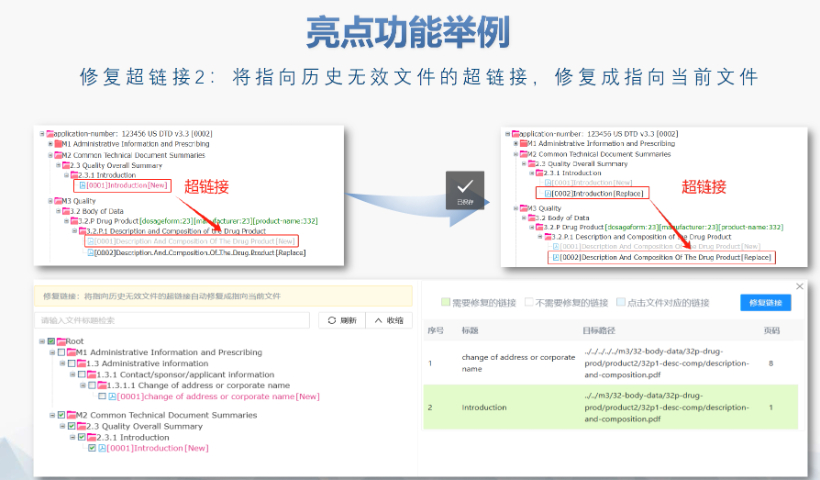
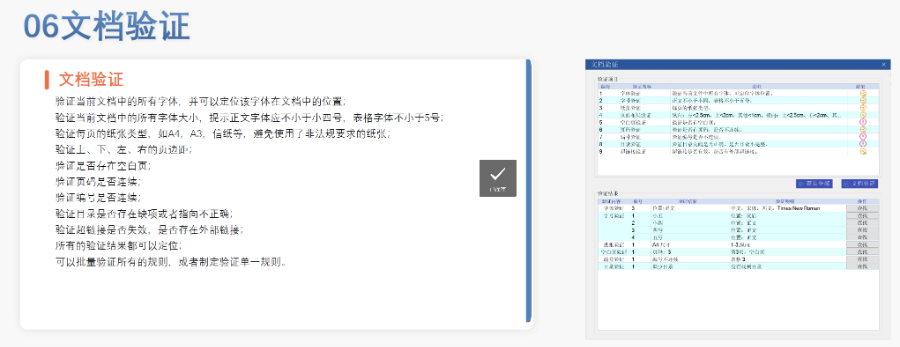
PDF工具箱 批量處理與格式修復(fù) 支持PDF合并,、拆分,、提取頁面、旋轉(zhuǎn)頁面等操作,,可批量修復(fù)字體未嵌入,、超鏈接錯誤等問題,確保文件符合藥品注冊法規(guī)要求,。 智能書簽與超鏈接管理 提供書簽導(dǎo)入/導(dǎo)出,、超鏈接自動生成(支持關(guān)鍵字搜索定位鏈接),、題注超鏈接拖拽式編輯等功能,簡化復(fù)雜文檔的導(dǎo)航設(shè)計,。 文檔轉(zhuǎn)換與OCR識別 支持Word轉(zhuǎn)PDF(自動生成書簽,、嵌入字體),以及PDF與Word,、Excel等格式互轉(zhuǎn),,集成OCR功能用于掃描件文字識別。 合規(guī)性驗證 自動驗證PDF的頁面布局,、頁碼連續(xù)性,、空白頁、目錄層級等屬性,,并定位具體錯誤位置,,減少人工檢查成本。 安全與協(xié)作功能 支持文檔加密,、數(shù)字簽名,、云端同步及多設(shè)備共享,滿足企業(yè)級文件安全管理需求,。
DMF維護與合規(guī) 年度更 即使無變更,,每年需提交聲明;重大工藝/設(shè)施變更需及時通知客戶并更文件,。 現(xiàn)場檢查 原料藥企業(yè)需通過FDA現(xiàn)場檢查,,驗證是否符合ICH Q7 GMP標準,并與DMF內(nèi)容一致,。 轉(zhuǎn)讓與關(guān)閉 轉(zhuǎn)讓:需書面通知FDA并提供持有者信息,。 關(guān)閉:未提交年度報告或持有人主動申請,需說明原因并通知所有授權(quán)方,。 關(guān)鍵注意事項 數(shù)據(jù)質(zhì)量:所有資料需準確,、完整,,減少審核延遲風險,。 合規(guī)性:遵循FDA指南(如21 CFR Part 207)及USP標準(如培養(yǎng)基物料來源級別)。 溝通機制:建議通過專業(yè)機構(gòu)(如瑞歐佰藥)協(xié)助,,定期提交周報并制定計劃表以提高效率,。 常見問題解答 生物制品分類:培養(yǎng)基、外泌體等均屬Ⅱ類DMF,。 質(zhì)量標準:參考USP及同行標準,,需提供分析方法驗證及雜質(zhì)對比研究。 周期估算:資料準備約5-50個工作日,,總周期受缺陷回復(fù)影響,。美國eCTD注冊外包相關(guān)技術(shù)支持,。
多國審評程序與eCTD遞交途徑的適配:歐盟藥品審評程序包括集中(CP)、分散(DCP),、互認(MRP)和國家程序(NP),,eCTD需適配不同程序的遞交要求。例如: 集中審評程序(CP):通過EMA的eSubmission Gateway提交,,審評時限約240個工作日,,eCTD需包含完整的模塊1-5及多語言標簽文件。 分散審評程序(DCP):需通過CESP(歐盟共同提交門戶)遞交,,參考成員國(RMS)主導(dǎo)審評,,eCTD需支持多國同步評估的模塊化拆分。 互認程序(MRP):已授權(quán)成員國作為RMS,,eCTD需包含基線序列(Baseline Sequence 0000)以整合歷史審評數(shù)據(jù),,并通過CMDh協(xié)調(diào)分歧。美國eCTD申報軟件相關(guān)技術(shù)支持,。安徽化學藥品eCTD軟件
eCTD驗證標準相關(guān)技術(shù)支持,。浙江賦悅科技eCTD銷售電話
中國將進一步與國際接軌,推進eCTD等標準應(yīng)用,,提高藥品注冊效率和質(zhì)量,。AI技術(shù)可能在藥品注冊領(lǐng)域廣泛應(yīng)用,如輔助審評人員工作,。未來藥品注冊資料將更注重結(jié)構(gòu)化數(shù)據(jù),,有助于監(jiān)管機構(gòu)高效獲取和利用數(shù)據(jù)。 eCTD等數(shù)字化工具將推動藥品監(jiān)管向智慧監(jiān)管和全生命周期監(jiān)管發(fā)展,,提高監(jiān)管效率和質(zhì)量,。區(qū)塊鏈技術(shù)具有應(yīng)用前景,可構(gòu)建全球統(tǒng)一的藥品申報數(shù)據(jù)平臺,。數(shù)據(jù)化時代,,藥品注冊領(lǐng)域?qū)⒏⒅財?shù)據(jù)收集、分析和利用,,為監(jiān)管機構(gòu)和企業(yè)提供決策支持,。 總而言之,展望未來,,隨著eCTD在藥品注冊領(lǐng)域的廣泛應(yīng)用和不斷發(fā)展,,中國將逐步建立起與國際接軌的藥品注冊體系。這將有助于提高中國藥品注冊的效率和質(zhì)量,,推動中國藥品走向世界舞臺,。同時,企業(yè)也需要密切關(guān)注技術(shù)發(fā)展動態(tài)和監(jiān)管政策變化,及時調(diào)整自身戰(zhàn)略和規(guī)劃,,以適應(yīng)未來的市場競爭和監(jiān)管要求,。浙江賦悅科技eCTD銷售電話