�|������eCTD �N�ķ��� �x���Ƽ�����
�l(f��)؛���c���㽭ʡ������
�l(f��)���r�g��2025-04-23
�l(f��)؛���c���㽭ʡ������
�l(f��)���r�g��2025-04-23
�������u�����ceCTD�f��;�����m�䣺�W��ˎƷ���u����������У�CP������ɢ��DCP��,�����J��MRP���͇��ҳ���NP��,��eCTD���m�䲻ͬ������f��Ҫ�����磺 ���Ќ��u����CP����ͨ�^EMA��eSubmission Gateway�ύ�����u�r�s240��������,��eCTD�����������ģ�K1-5�����Z�Ԙ˺��ļ�,�� ��ɢ���u����DCP������ͨ�^CESP���W�˹�ͬ�ύ�T�����f���������ɆT����RMS���������u,��eCTD��֧�ֶ���ͬ���u����ģ�K�����,�� ���J����MRP�������ڙ�ɆT������RMS��eCTD������������У�Baseline Sequence 0000�������Ϛvʷ���u��(sh��)��(j��),����ͨ�^CMDh�f(xi��)�{(di��o)����,������eCTDע��������P���g֧�֡��|������eCTD
����ˎ�����ļ���Drug Master File, DMF������FDA�ύ�ęC�ܼ��g�ļ�,������֧��ˎƷ���a(ch��n),���|(zh��)�����Ƽ���Ҏ(gu��)�Ԍ��顣��������Ҫ�c�����̿��Y(ji��)�� DMF�����c��� ���x�c���� DMF��ˎƷ���a(ch��n)ȫ�^�̵�Ԕ���n��,������ԭ��ˎ,���o�ϡ����b���ϵȵ����a(ch��n)�Oʩ,����ˇ,���|(zh��)�����Ƶ���Ϣ�����Ƅ��S��������֧����ע����Ո,�������x���ڱ��o��I(y��)�C�ܵ�ͬ�r,���M��FDA����������ȵ�Ҫ�� DMF��� ���ԭ��ˎ,�����g�w���Ƅ��������������w,���������������Ʒ���ٴ���� ������b����,�� ����o��,����ɫ�������ӄ��� ������R��/�R����(sh��)��(j��)��������Ϣ����FDA�A�����ʣ�,�� ע�����ͣ����a(ch��n)�Oʩ�c�ˆT������2000��ͣ��,���|������eCTD���ô�eCTD���ܛ�����P���g֧�֡�
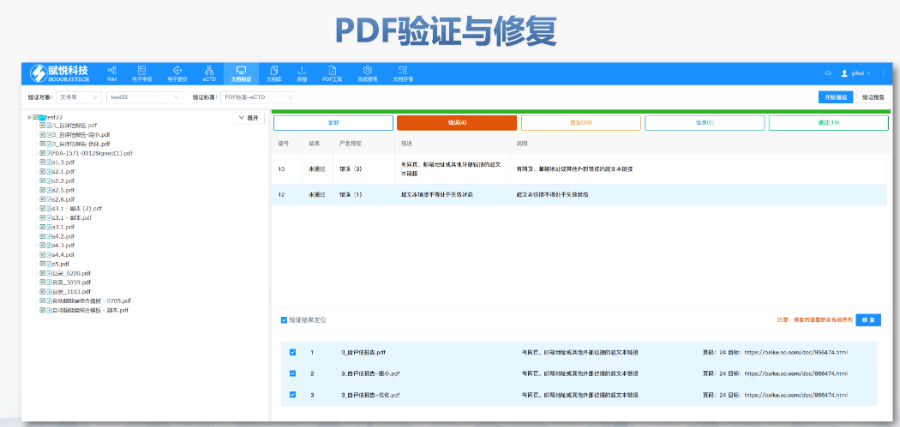
����eCTD��C��������������e�`�������������,�������桱�����h������,������ʾ��Ϣ����������������,��PDF�ļ��汾��������ܱ��o���ڡ��e�`��,��������·���������Ԅt�����О顰���桱����Cʧ����ֱ�ӌ����ˌ�,����I(y��)��ͨ�^LORENZ Validator�ȹ����A�z,���_���ύǰ��Ҏ(gu��),�� ���g��C�c ��C���wXML�Y(ji��)����Ҏ(gu��)�ԡ��ļ�����Ҏ(gu��)�t,���������ڹ�����������̖�B�m(x��)�ԣ���PDF���ԣ������wǶ��,���������ԣ�,���R��ԇ(sh��)��(j��)���~��M��CDISC�˜�,������SDTM��ADaM��(sh��)��(j��)���ĽY(ji��)����C
�W��eCTD��ʩ��(j��ng)��S�����Ї��ɽ��b�Լ����M��,���Ї����ܕ���(j��ng)�v����I(y��)��ԸeCTD�ύ������eCTD�ύ���^��,���Ҍ��o�SICH������������CMC�Y����������,��ȫ������eCTD 4.0�^��,���Ї�Ҳ�����⣬���S�ձ�,���W��,�������ȏ��ƌ�ʩ�������M�� �Ї���������ȫ�����C��,��eCTD��ʩ�������Ї���I(y��)��������,�����g�M��������eCTD��ʩ����I(y��)�������Pע���g�ӑB(t��i),���{(di��o)����(zh��n)��,���S������(n��i)�͘I(y��)�����������I(y��)�����������ӣ��˽�eCTD�ȇ��H�˜ʌ��ɞ��I(y��)�l(f��)չ����Ҫ������,�� �Ї����MeCTD���挦��ɫ���},�������к���Ո�Y��ƥ�䣬����I(y��)�c�O(ji��n)�ܙC����ͬ��Q,�,�����Ҫ�����P�I���Ї����ƶ��m�χ����Ҫ��,���ڴ�δ���(zh��)��ָ�ϼȾ���ɫ���c���H��܉,����eCTD��ʩ�ṩ֧�֡���ANDAע��������P���g֧��,��

�Oʩ�M�ӑB(t��i)�{(di��o)�� API���S���Ƅ����S���M�քe�s6.8�f��14.5�f��Ԫ��2025ؔ�꣩,��CMO���S�M�Þ��Ƅ��M��24%������S���~��֧��1.5�f��Ԫ�羳�z���M,�� �U�M�r���c���P �M������ؔ�����գ�10��1�գ���20���(n��i)�U�{,�����ڌ�������Ƿ���β���ͣANDA����������ˎƷҕ��ð�Ʈa(ch��n)Ʒ,�� �����c�������� PETˎ��,�����̘I(y��)�a(ch��n)Ʒ��ͣ�a(ch��n)��һ��Ĺ��S�ɻ����U�M,�����U�M���S����ȃ�(n��i)�o���a(ch��n)��ӣ������U�{�M��,�� �ИI(y��)Ӱ��c���� �M���ϝq�Ƅ���I(y��)��(y��u)��������,�����缯��ANDA�ύ���ڡ�����CMO��������Oʩ�M,����ͨ�^�A�J�C����DMF�������u�����p���؏�֧��,�� ���ô�eCTDע����ԃ���P���g֧�֡�����CDE eCTD���ý�Q����
�W��DMFע��������P���g֧��,���|������eCTD
����eCTD�ď��ƌ�ʩ�r�g�c������������2017��5��5����Ҫ��ˎ��Ո��NDA��,������ˎ��Ո��ANDA����������Ʒ�S����Ո��BLA�����ͨ�^eCTD��ʽ�ύ��2018��5��5���Mһ���Uչ���R��ԇ���Ո��IND����ˎƷ���ļ���DMF��,��FDAͨ�^��(li��n)��ʳƷ,��ˎƷ�ͻ��yƷ��������745A�l���_����ύ�ď����ԣ�������̘I(y��)��IND�Ͳ���DMF��ͣ�����,��2023�ꔵ(sh��)��(j��)�@ʾ,��F(xi��n)DA���յ�eCTD��Ոռ�����_92%����־����ӻ����u�wϵ�ij���,����I(y��)��δ��Ҏ(gu��)���ύ����ȱ��us-regional.xml�ļ����؏�����̖��,����ֱ�ӱ����ա��|������eCTD