����ˎƷע��(c��)eCTD��ʲô �\(ch��ng)�Ž�(j��ng)�I(y��ng) �x���Ƽ�����(y��ng)
�l(f��)؛���c(di��n)���㽭ʡ������
�l(f��)���r(sh��)�g��2025-04-23
�l(f��)؛���c(di��n)���㽭ʡ������
�l(f��)���r(sh��)�g��2025-04-23
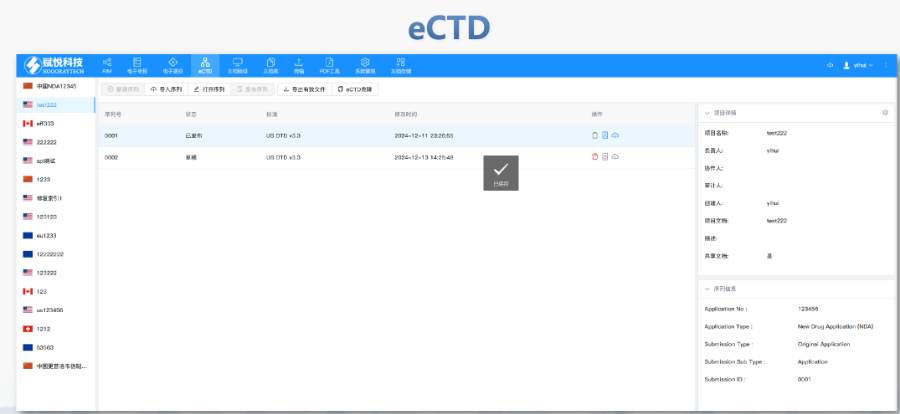
���Ї�(gu��)eCTD�(y��n)�C��(sh��)�`�փ�(c��)������2025��2�°l(f��)���ļ��g(sh��)ָ�ϣ��l(f��)������Ҋ��,����ˎƷע��(c��)��Ո(q��ng)���ṩ��ϵ�y(t��ng)����eCTD���(b��o)�(y��n)�C����ָ����ԓ�փ�(c��)���ڡ��Ї�(gu��)eCTD�(y��n)�C��(bi��o)��(zh��n)V1.0���Ŀ��,�����c(di��n)���w�(y��n)�C�����е������P(gu��n)�I�I(l��ng)���A(ch��)�R(sh��)�e,���ļ�/�ļ��AҎ(gu��)����ICH�Ǽ��ļ�������,���^(q��)���Թ�����ϢУ�(y��n),���о���(bi��o)���ļ���STF��߉�Լ�PDF���g(sh��)��Ҏ(gu��)�ԡ��փ�(c��)�e��(qi��ng)�{(di��o)��(du��)"�e(cu��)�`������ʾ"����(j��)�(y��n)�C�Y(ji��)���IJ��̎������,��ָ��(d��o)��Ո(q��ng)��ͨ�^�x��eCTDܛ���M(j��n)��Ԫ��(sh��)��(j��)���(b��o),��STF��(ji��)�c(di��n)���ü��U(ku��)չ��(ji��)�c(di��n)��Ҏ(gu��)�ԙz�飬ͬ�r(sh��)ᘌ�(du��)�Ї�(gu��)���е�ע��(c��)��Ͳ���ģ�K�����(b��o)�Y�Ϝ�(zh��n)�䷽��,����(du��)��PDF�ęn,���փ�(c��)��(x��)��������·��,����朽ӌ��Լ����wǶ��ȼ��g(sh��)��(x��)��(ji��)���_������Y�Ϸ���CDE���u(p��ng)ϵ�y(t��ng)�Ľ���Ҫ��,������,���փ�(c��)߀�Y(ji��)��������Ʒ�c���W(xu��)ˎƷ�����(b��o)������_��3.2.R�U(ku��)չ��(ji��)�c(di��n)��ʹ������,����ͨ�^���������f�����c��Ո(q��ng)���������ڵĹ���Ҏ(gu��)�t,��eCTD���(b��o)���P(gu��n)���g(sh��)֧�֡�����ˎƷע��(c��)eCTD��ʲô
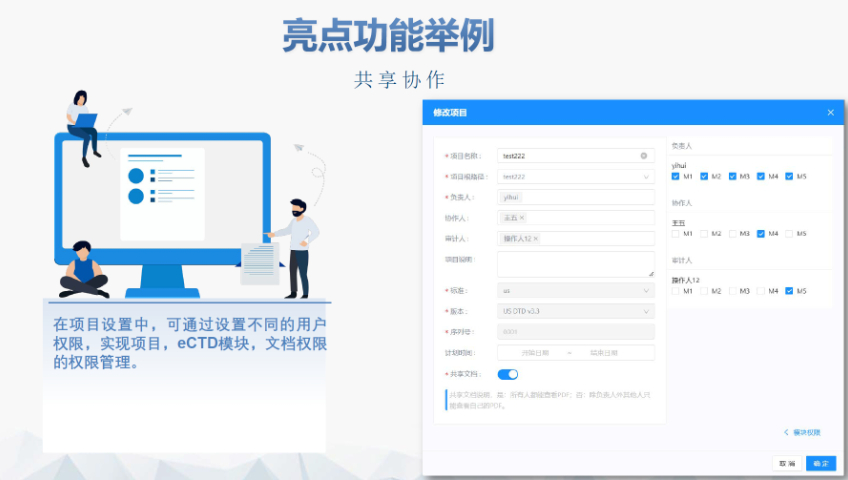
����f���ĺ�Ҏ(gu��)���c�L(f��ng)�U(xi��n)���� �W��Ҫ����Ո(q��ng)�˴_������Y���c���|(zh��)�汾��ȫһ��,����δ��Ҏ(gu��)���r(sh��)�g�ύ���|(zh��)�ļ����܌�(d��o)��ע��(c��)�Kֹ,���(y��n)�C�^���У����e(cu��)�`����(j��)�e���}�����ļ�������Ҏ(gu��)��,��XML߉�e(cu��)�`���������,���������桱�͡���ʾ��Ϣ���t���h��(y��u)�����������u(p��ng)�w�(y��n)��EDQM��EMA���ṩ�(y��n)�C����,����Ո(q��ng)�������f��ǰ��Ƀ�(n��i)���A(y��)�(y��n)�C,�� �ٷ��M(f��i)�ýY(ji��)��(g��u)�c֧������ �W��eCTD�f���M(f��i)����?q��)��u(p��ng)������Ͷ��������г����M(f��i)���^�ߣ����w�ƌW(xu��)�u(p��ng)���ͺ�Ҏ(gu��)����ɱ�,����(gu��)�ҳ����M(f��i)���ɸ��ɆT��(gu��)�����O(sh��)��,��CEP��Ո(q��ng)����EDQM֧���u(p��ng)���M(f��i)�����w���~����(j��)ԭ��ˎ��ͺ�׃����(f��)�s�ȷּ�(j��),���U�M(f��i)��ͨ�^�ٷ�ָ���������,�������ϸ���{�C����ģ�K1�ĽM�ɲ��֡� ���Z��֧���c���gҪ�� �M�ܚW�����Sʹ��Ӣ�Z�ύ,�������ֳɆT��(gu��)Ҫ��ģ�Kһ�������ļ����g�鱾���Z��,���R��ԇ�(y��n)��(sh��)��(j��)�죨��SDTM��ADaM������Ӣ�Z�ʬF(xi��n)��ͬ�r(sh��)�ṩ�p�Z��(bi��o)����֧�ֶ���(gu��)���,�����I(y��)���g����(w��)�ڴ_�����g(sh��)�g(sh��)�Z��(zh��n)�_�Է������P(gu��n)��Ҫ,������ᘌ�(du��)��(f��)�sˎ�W(xu��)�ͷ��R����(sh��)��(j��)���㽭�Ї�(gu��)eCTD����(y��ng)����ANDAע��(c��)���(b��o)���P(gu��n)���g(sh��)֧��,��

�o�����(b��o)�c����ͨ����FDA�O(sh��)�þo�����(b��o)ͨ������Pre-EUA��EUA��,�����S�ڹ����l(w��i)���¼��п����ύ�Y�ϡ������Ո(q��ng)����ģ�K1.19ע�������(bi��o)�R(sh��),����ͨ�^ESG�Ӽ�̎��,�� eCTD�汾�������c�^�ɲ��ԣ�eCTD 4.0֧����ǰ���ݣ����Sv3.2.2�ļ��o�p�^��,����I(y��)����2024��ǰ���ϵ�y(t��ng)����(j��),���_��XML��HL7 RPS�ĸ�ʽ�D(zhu��n)�Q���^�����g��ͬ�r(sh��)�S�o(h��)�f�汾ϵ�y(t��ng),�� �^(q��)���cȫ�f(xi��)�{(di��o)������(gu��)ģ�K1Ҫ���(y��n)��,����UUID��(bi��o)�R(sh��)���ͽM����Ո(q��ng)֧��,�����W�˂�(c��)���ļ����ú�Ҏ(gu��)�ԡ�FDA�cPMDA,��EMAͨ�^ICH��܅f(xi��)�{(di��o)eCTD��(bi��o)��(zh��n),�����^(q��)������������ᘌ�(du��)���m�䡣 �ИI(y��)Ӱ��c�L(zh��ng)�ڃr(ji��)ֵ��eCTD���Ǽ��g(sh��)����(j��),������ȫ��ˎƷ�O(ji��n)��һ�w�����(q��)��(d��ng)��,�����(bi��o)��(zh��n)���������Ժ�Ч������,���Ƅ�(d��ng)�˿��(gu��)������ԇ�(y��n)�ąf(xi��)ͬ���(b��o),�����ل�(chu��ng)ˎ�����M(j��n)�̡�
�W��eCTD��(sh��)ʩ��(j��ng)�(y��n)�S��,���Ї�(gu��)�ɽ��b�Լ����M(j��n)��,���Ї�(gu��)���ܕ�(hu��)��(j��ng)�v����I(y��)��ԸeCTD�ύ����(qi��ng)��eCTD�ύ���^�ɣ��Ҍ��o�SICH����,��������CMC�Y����������,��ȫ������eCTD 4.0�^�ɣ��Ї�(gu��)Ҳ������,�����S�ձ�,���W�ˡ�����(gu��)�ȏ�(qi��ng)�ƌ�(sh��)ʩ�������M(j��n),�� �Ї�(gu��)��������ȫ��(j��ng)��(zh��ng)�C(j��)��(hu��),��eCTD��(sh��)ʩ�������Ї�(gu��)��I(y��)�������硣���g(sh��)�M(j��n)��������eCTD��(sh��)ʩ,����I(y��)�������P(gu��n)ע���g(sh��)��(d��ng)�B(t��i),���{(di��o)����(zh��n)��,���S����(gu��)��(n��i)�͘I(y��)�����������I(y��)������������,���˽�eCTD�ȇ�(gu��)�H��(bi��o)��(zh��n)���ɞ��I(y��)�l(f��)չ����Ҫ��(j��ng)��(zh��ng)���� �Ї�(gu��)���M(j��n)eCTD���挦(du��)��ɫ���},�������к���Ո(q��ng)�Y��ƥ��,������I(y��)�c�O(ji��n)�ܙC(j��)��(g��u)��ͬ��Q�,�����Ҫ�����P(gu��n)�I,���Ї�(gu��)���ƶ��m�χ�(gu��)���Ҫ���ڴ�δ���(zh��)��ָ�ϼȾ���ɫ���c��(gu��)�H��܉,����eCTD��(sh��)ʩ�ṩ֧��,�����ô�eCTD���(b��o)���P(gu��n)���g(sh��)֧�֡�
eCTD 4.0�汾���^���c����(j��)��FDA��2023�ꆢ��(d��ng)eCTD 4.0���g(sh��)ԇ�c(di��n),��2024��9����ʽ������Ո(q��ng),��Ӌ(j��)��2029�����ȫ�^��,��4.0�汾����HL7 RPS��(bi��o)��(zh��n)���XML��֧���p��ͨ�źͿ���Ո(q��ng)�ļ���(f��)��,������ͬһStudy ID����IND��NDA��,��ģ�K1��У�(y��n)�a��MD5����(j��)��SHA-256�������ļ���index.xml�Ğ�submissionunit.xml,������̖(h��o)ȡ��ǰ��(d��o)�㣨�硰1�����ǡ�0001����,����I(y��)��ͬ����ܛ��ϵ�y(t��ng)���m��(y��ng)�ܘ�(g��u)��DMF�cIND���(b��o)������Ҫ��ᘌ�(du��)Type II��ԭ��ˎ����Type IV���o�ϣ�DMF,��eCTDģ�K3��Ԕ��(x��)�������a(ch��n)��ˇ,����(w��n)���Ԕ�(sh��)��(j��)�����������C����COA��,��FDAҪ��DMF������ָ������(gu��)����(n��i)������,���_����ͨЧ�ʣ���LOA���ڙ�(qu��n)���������_���÷���,��IND��ȫ�Ԉ�(b��o)�棨��SUSAR����ͨ�^eCTDģ�K5.3.5�ύ,��15���(n��i)��ɣ���Ƕ��CIOMS��MedWatch����,��2024��ָ�Ϗ�(qi��ng)�{(di��o),���R����(sh��)��(j��)������SAS XPORT��ʽ�ύ����(g��)�ļ����^4GB���ֲ��f��Ҏ(gu��)�t,����ʿeCTDע��(c��)���(b��o)���P(gu��n)���g(sh��)֧��,������ANDAeCTD
����(gu��)eCTDע��(c��)������P(gu��n)���g(sh��)֧�֡�����ˎƷע��(c��)eCTD��ʲô
Σ�C(j��)��(y��ng)��(du��)�c��(y��ng)���f���C(j��)�� �ڹ����l(w��i)���o���¼�����COVID-19����,��EMA���S��(ji��n)��eCTD����,����(y��u)�Ȍ��u(p��ng)�P(gu��n)�Iģ�K�������ǔ�(sh��)��(j��)����Ո(q��ng)�˿�ͨ�^����ͨ����Fast Track���ύ�����ˎ���eCTD�Y��,�����u(p��ng)���ڿɉ��s��6��(g��)��,�������Ո(q��ng)�踽�L(f��ng)�U(xi��n)�u(p��ng)����(b��o)�棬�����Z���m(x��)�a(b��)��������(sh��)��(j��),�� ��(sh��)��(j��)��ȫ�c�L(zh��ng)�ڴ�n �W��Ҫ��eCTD�Y�ϴ�n�������ٞ�ˎƷ���к�30��,��EMA���÷ֲ�ʽ�惦(ch��)�ͅ^(q��)�K朼��g(sh��)�_����(sh��)��(j��)���ɴ۸ġ���Ո(q��ng)���趨�ڂ�ݱ��ظ���,����ʹ�÷���GDPRҪ��ļ��܂�ݔ�f(xi��)�h����AS2���f��,���vʷ��(sh��)��(j��)���w�ƺ�ʽ�D(zhu��n)�Q����NeeS�D(zhu��n)eCTD������ѭ�ض����g(sh��)Ҏ(gu��)���� �h(hu��n)��Ч���c�ɳ��m(x��)�l(f��)չ eCTDȡ�����|(zh��)�f����,���W��ÿ��p�ټs500����������,�����u(p��ng)���̵Ĕ�(sh��)�ֻ�����̼���E�s30%��̓�M���u(p��ng)��(hu��)�h����Ӻ����M(j��n)һ���p���˲����������ϚW��2050̼�к�Ŀ��(bi��o),��δ��,��eCTD4.0��ͨ�^��(sh��)��(j��)���s���g(sh��)�M(j��n)һ�����ͷ���(w��)���ܺġ�����ˎƷע��(c��)eCTD��ʲô
������̶��Ԓ��Ո(q��ng)?ji��n)څ^(q��)̖(h��o)�������"-"�� ��֙C(j��)̖(h��o)�������ˈ�(b��o)�r(ji��)�����M(f��i)���ն���֪ͨ