歐美eCTD實施經(jīng)驗豐富,,中國可借鑒以加速進(jìn)程,。中國可能會經(jīng)歷從企業(yè)自愿eCTD提交到強制eCTD提交的過渡,且將緊隨ICH步伐,,尤其在CMC資料整理方面,。全球正向eCTD 4.0過渡,中國也不例外,,將隨日本,、歐盟、美國等強制實施而逐步推進(jìn),。 中國崛起帶來全球化競爭機會,,eCTD實施將助力中國企業(yè)走向世界。技術(shù)進(jìn)步將加速eCTD實施,,企業(yè)需密切關(guān)注技術(shù)動態(tài),,調(diào)整戰(zhàn)略。隨著國內(nèi)就業(yè)壓力增大和企業(yè)出海需求增加,,了解eCTD等國際標(biāo)準(zhǔn)將成為職業(yè)發(fā)展的重要競爭力,。 中國推進(jìn)eCTD需面對特色問題,如上市后申請資料匹配,,需企業(yè)與監(jiān)管機構(gòu)共同解決,。基線要求是關(guān)鍵,,中國需制定適合國情的要求,。期待未來執(zhí)行指南既具特色又與國際接軌,為eCTD實施提供支持,。澳大利亞eCTD注冊外包相關(guān)技術(shù)支持,。江蘇新藥eCTD格式
中國將進(jìn)一步與國際接軌,推進(jìn)eCTD等標(biāo)準(zhǔn)應(yīng)用,,提高藥品注冊效率和質(zhì)量,。AI技術(shù)可能在藥品注冊領(lǐng)域廣泛應(yīng)用,如輔助審評人員工作,。未來藥品注冊資料將更注重結(jié)構(gòu)化數(shù)據(jù),有助于監(jiān)管機構(gòu)高效獲取和利用數(shù)據(jù),。 eCTD等數(shù)字化工具將推動藥品監(jiān)管向智慧監(jiān)管和全生命周期監(jiān)管發(fā)展,,提高監(jiān)管效率和質(zhì)量。區(qū)塊鏈技術(shù)具有應(yīng)用前景,,可構(gòu)建全球統(tǒng)一的藥品申報數(shù)據(jù)平臺,。數(shù)據(jù)化時代,藥品注冊領(lǐng)域?qū)⒏⒅財?shù)據(jù)收集,、分析和利用,,為監(jiān)管機構(gòu)和企業(yè)提供決策支持,。 總而言之,展望未來,,隨著eCTD在藥品注冊領(lǐng)域的廣泛應(yīng)用和不斷發(fā)展,,中國將逐步建立起與國際接軌的藥品注冊體系。這將有助于提高中國藥品注冊的效率和質(zhì)量,,推動中國藥品走向世界舞臺,。同時,企業(yè)也需要密切關(guān)注技術(shù)發(fā)展動態(tài)和監(jiān)管政策變化,,及時調(diào)整自身戰(zhàn)略和規(guī)劃,,以適應(yīng)未來的市場競爭和監(jiān)管要求。上海國際注冊eCTD使用加拿大eCTD驗證標(biāo)準(zhǔn)相關(guān)技術(shù)支持,。

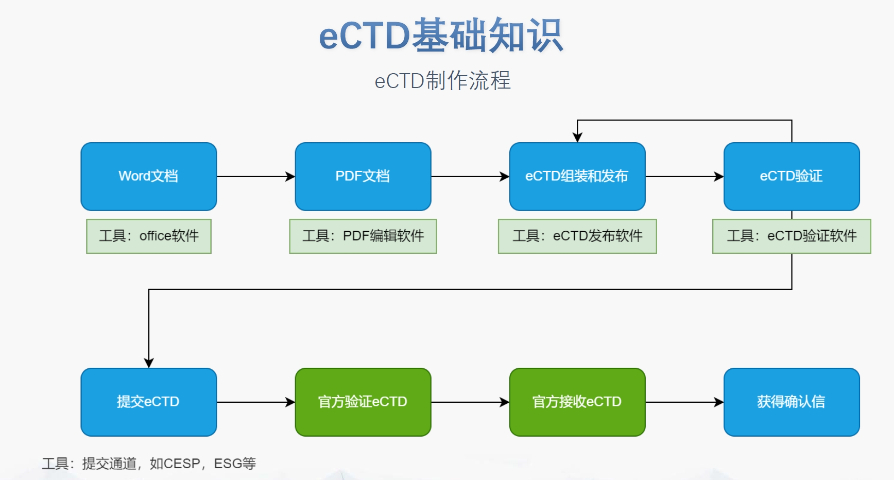
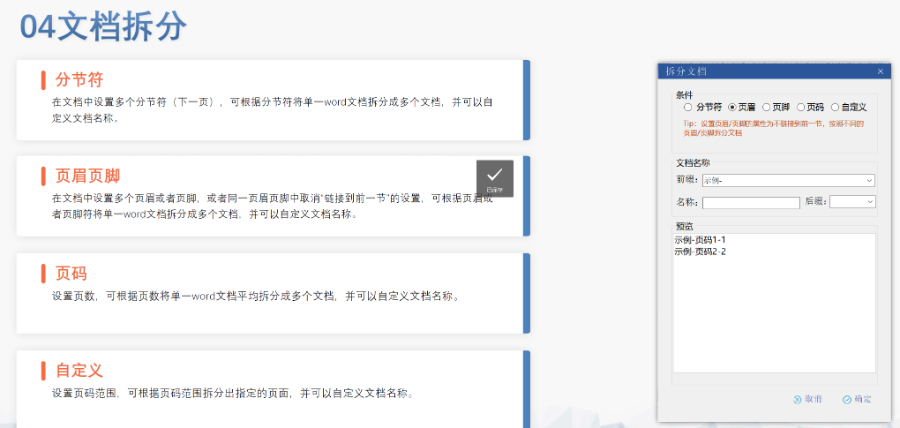
內(nèi)容與格式檢查Word預(yù)處理:需檢查拼寫,、縮略語、單位格式(如),,設(shè)置多級列表自動編號(如),,統(tǒng)一字體(宋體/TimesNewRoman)和段落格式。重復(fù)內(nèi)容處理:相同劑型不同規(guī)格可共用模塊3,,但需區(qū)分包裝系統(tǒng)(如,、)。外文資料:中文在前,、原文在后,,參考文獻(xiàn)需中英文對照并建立跨網(wǎng)頁鏈接。使用符合ICH標(biāo)準(zhǔn)的eCTD編輯器自動生成XML骨架和MD5校驗值,,拖拽PDF文件構(gòu)建結(jié)構(gòu)樹,。序列管理:序列號從0000開始遞增,每次提交需更新序列,,生命周期狀態(tài)(New/Replace/Delete)需在XML中明確標(biāo)注,。驗證與遞交:確保無驗證錯誤(如書簽缺失、超鏈接斷鏈),,通過ESG等電子通道傳輸,,光盤封面需包含申請?zhí)柡托蛄刑枴H芷诠芾戆姹荆和ㄟ^軟件實現(xiàn)網(wǎng)頁簽入/簽出,、審批流程,,支持歷史版本追溯。變更管理:增補(Append)和替換(Replace)需關(guān)聯(lián)原始序列,,刪除(Delete)需徹底移除無效文件,。
eCTD的實施為監(jiān)管機構(gòu)和企業(yè)帶來了多重機遇。電子化申報資料能夠極大地加速審評效率,,減少人為判斷錯誤和數(shù)據(jù)混淆的情況,,從而提高審評的準(zhǔn)確性和速度,。同時,eCTD帶來的數(shù)據(jù)標(biāo)準(zhǔn)化機遇使得全球監(jiān)管機構(gòu)的資料內(nèi)容和電子格式得以統(tǒng)一,,有助于在不同監(jiān)管機構(gòu)之間進(jìn)行數(shù)據(jù)傳輸和共享,。這對于提升全球監(jiān)管效率和行業(yè)研發(fā)效率具有重要意義。 此外,,eCTD的實施還促進(jìn)了國際合作,,構(gòu)建了全球監(jiān)管的底層大數(shù)據(jù)基礎(chǔ)。對于企業(yè)而言,,eCTD提供了一個規(guī)范化的研發(fā)活動模板,,有助于降低與監(jiān)管機構(gòu)溝通的成本,提高申報效率,。特別是對于國內(nèi)的生物技術(shù)企業(yè)而言,,eCTD的實施更是具有重要意義,有助于這些企業(yè)更好地走向國際市場,。然而,,中小企業(yè)在享受這些機遇的同時,也面臨著技術(shù)和成本壓力,。eCTD的實施需要專門的團隊進(jìn)行系統(tǒng)維護和開發(fā),,這對于中小企業(yè)來說是一筆不小的開支。同時,,數(shù)據(jù)安全問題也是企業(yè)關(guān)注的焦點,。 此次CDE擴大eCTD實施范圍對行業(yè)而言是一個積極的風(fēng)向標(biāo)。短期內(nèi),,企業(yè)面臨的挑戰(zhàn)包括適應(yīng)更高要求的技術(shù)規(guī)范并提高文件質(zhì)量,、和eCTD出版系統(tǒng)的磨合以及進(jìn)行eCTD知識的跨職能培訓(xùn)等。 eCTD驗證實踐手冊相關(guān)技術(shù)支持,。
歐洲藥品管理局:集中審評程序由歐洲藥品管理局(European Medicines Agency, EMA)負(fù)責(zé)協(xié)調(diào),。 人用藥品委員會:人用藥品委員會(Committee for Medicinal Products for Human Use, CHMP)負(fù)責(zé)提供科學(xué)意見。 歐盟委員會:CHMP的意見隨后被提交給歐盟委員會(European Commission, EC),,由歐盟委員會做出是否授權(quán)的終決定,。這個決定在整個歐盟都是具有法律約束力的。 審批過程: 申請人向EMA提交申請,,包括eCTD(電子通用技術(shù)文檔)格式的藥品注冊文檔,。 EMA的CHMP分配一個科學(xué)評估團隊(Rapporteur和Co-Rapporteur),負(fù)責(zé)初步評估,。 CHMP基于評估團隊的報告提供科學(xué)意見。 歐盟委員會根據(jù)CHMP的意見做出終決定,,批準(zhǔn)或拒絕藥品上市,。 授權(quán)范圍 如果藥品獲得批準(zhǔn),,將獲得在整個歐盟,、冰島,、列支敦士登和挪威有效的上市許可(Central Marketing Authorisation, CMA)。加拿大eCTD申報軟件相關(guān)技術(shù)支持,。山東ANDAeCTD便宜
美國eCTD注冊咨詢相關(guān)技術(shù)支持,。江蘇新藥eCTD格式
2015年發(fā)布《關(guān)于藥品醫(yī)療器械審評審批制度的意見》,,提出藥監(jiān)五大目標(biāo),將eCTD納入國家藥監(jiān)數(shù)字化戰(zhàn)略,。2017年,,中國加入ICH(國際人用藥品注冊技術(shù)協(xié)調(diào)會),成為全球第八個監(jiān)管機構(gòu)成員,,加速與國際標(biāo)準(zhǔn)接軌,。2018年,國家藥監(jiān)局(NMPA)完成eCTD文檔管理系統(tǒng)招標(biāo),,由上海寶信與德國LORENZ合作搭建技術(shù)平臺,,標(biāo)志著技術(shù)基礎(chǔ)設(shè)施的落地。 規(guī)范制定與試點階段(2019-2023年) 2019-2020年,,CDE(藥品審評中心)發(fā)布《eCTD技術(shù)規(guī)范》《驗證標(biāo)準(zhǔn)》等征求意見稿,,并組織兩輪企業(yè)測試。2021年,,NMPA明確化學(xué)藥1類,、5.1類及生物制品1類上市申請適用eCTD。2022年實施電子申報(非eCTD格式),,2023年取消紙質(zhì)資料提交,,為eCTD鋪開奠定基礎(chǔ)。 實施與擴展階段(2024-2025年) 2024年3月更電子申報技術(shù)要求,,7月啟動網(wǎng)絡(luò)傳輸試點,。2025年1月27日,NMPA將eCTD適用范圍擴大至化藥1-5類臨床試驗及上市申請,、生物制品1-3類全流程,,覆蓋藥、仿制藥及生物類似藥,,實現(xiàn)與國際主流申報模式同步,。江蘇新藥eCTD格式