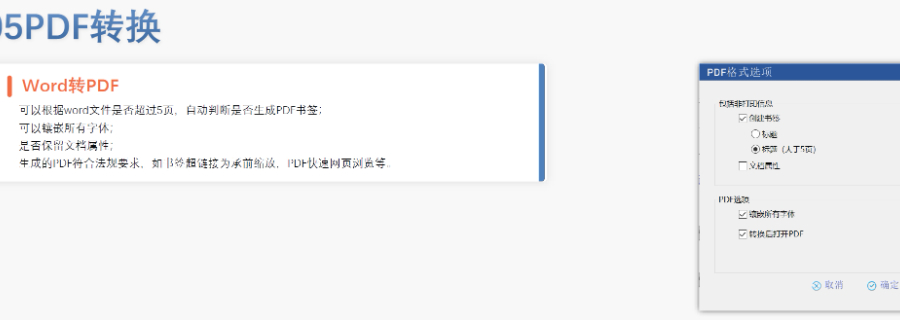
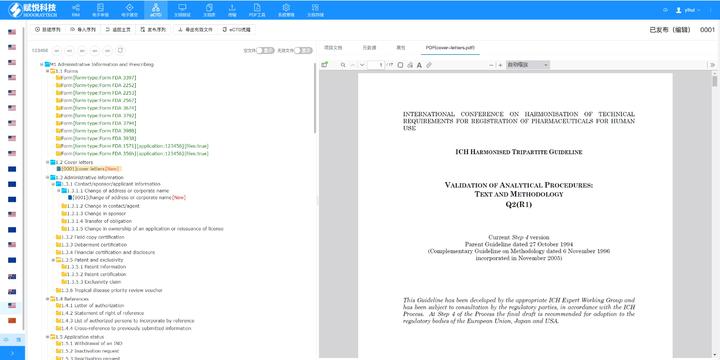
eCTD的技術(shù)架構(gòu)與模塊要求:美國eCTD基于XML技術(shù),,嚴(yán)格遵循ICH M4框架,分為5個模塊:模塊1(地區(qū)行政信息),、模塊2(技術(shù)總結(jié)),、模塊3-5(質(zhì)量,、非臨床與臨床數(shù)據(jù))。其中,,模塊1需包含F(xiàn)DA特定的us-regional.xml文件,,涵蓋申請編號、聯(lián)系人和DMF授權(quán)書等行政信息,。模塊2-5需與ICH CTD全球統(tǒng)一標(biāo)準(zhǔn)一致,,但FDA對文件顆粒度要求更細(xì),例如非臨床研究報(bào)告需拆分并標(biāo)記Study ID,。PDF文件需符合FDA v4.1格式規(guī)范,,包括字體嵌入、書簽層級和超鏈接功能,。加拿大eCTD申報(bào)相關(guān)技術(shù)支持,。黑龍江eCTD歡迎選購
ANDA遞交: 按照ICH M4的CTD格式整理資料,并以eCTD格式遞交,; 通過ESG通道遞交資料,; 收到CDER的letter,說明資料已經(jīng)進(jìn)入FDA數(shù)據(jù)庫,; 付GDUFA費(fèi),,在資料遞交后的10日內(nèi)到賬; ANDA接收: 繳費(fèi)后,,F(xiàn)DA初步審查資料的完整性,,并會在60天給答復(fù)。 第一種情況是ANDA無缺陷,,F(xiàn)DA給申請人發(fā)受理信(Acceptance Letter),; 第二種情況是ANDA包含少于10個小缺陷,F(xiàn)DA將會通過電話,、傳真,、電子郵件等方式通知發(fā)布IR (信息請求函),讓申請人在7個日歷日內(nèi)改正,,若未按時補(bǔ)充所有需要的資料,,F(xiàn)DA將拒收該ANDA; 第三種情況是ANDA包含1個或者多個重大缺陷,,或10個以上的小缺陷,,F(xiàn)DA將拒收該ANDA; 注:如果這邊被拒收,,只退75%的費(fèi)用,。河南CDE eCTD美國注冊鄧白氏號申請相關(guān)技術(shù)支持。
eCTD在歐盟藥品監(jiān)管中的歷史背景:歐盟eCTD(電子通用技術(shù)文檔)的發(fā)展始于對臨床試驗(yàn)和藥品審評流程標(biāo)準(zhǔn)化的需求。2001年,,歐盟引入《臨床試驗(yàn)指令》(CTD)作為統(tǒng)一的法律框架,,但其分散的成員國申報(bào)機(jī)制導(dǎo)致效率低下。2014年,,歐盟通過《臨床試驗(yàn)法規(guī)》(CTR, Regulation EU No. 536/2014),,要求通過CTIS平臺(臨床試驗(yàn)信息系統(tǒng))集中提交臨床試驗(yàn)申請(CTA),并逐步推動eCTD作為電子化申報(bào)的工具,。這一旨在解決傳統(tǒng)CTD模式下審評周期長,、多國協(xié)調(diào)成本高的問題,為eCTD的實(shí)施奠定了基礎(chǔ),。
仿制藥作為提高藥物可及性與可負(fù)擔(dān)性的一類藥物,,2012年以前,注冊審評是不收取任何費(fèi)用的,,但當(dāng)時仿制藥申請積壓嚴(yán)重,,從申報(bào)到獲批需要3~5年的時間。 美國國會于2012年頒布了仿制藥使用者費(fèi)用修正案(Generic Drug User Fee Amendments, GDUFA),,該法律要求制藥行業(yè)支付一定的用戶費(fèi)用,,以補(bǔ)充仿制藥申請的審評以及現(xiàn)場檢查的費(fèi)用,減少仿制藥申請積壓,,縮短審評時間,,增加基于風(fēng)險(xiǎn)的現(xiàn)場檢查等,,其目的是加快公眾獲得安全有效的仿制藥,,并降低行業(yè)成本。 GDUFA必須每五年重授權(quán)一次,,于2017年更(GDUFA II),,于2022年更(GDUFA III); 目前收費(fèi)種類分為以下四種:ANDA審評費(fèi),、DMF審評費(fèi),,在審評時一次性繳納;項(xiàng)目費(fèi)(Program fee),、設(shè)施費(fèi)(Facility fee),,是上市后每年繳納一次。歐盟eCTD注冊外包相關(guān)技術(shù)支持,。
多國審評程序與eCTD遞交途徑的適配:歐盟藥品審評程序包括集中(CP),、分散(DCP)、互認(rèn)(MRP)和國家程序(NP),,eCTD需適配不同程序的遞交要求,。例如: 集中審評程序(CP):通過EMA的eSubmission Gateway提交,審評時限約240個工作日,eCTD需包含完整的模塊1-5及多語言標(biāo)簽文件,。 分散審評程序(DCP):需通過CESP(歐盟共同提交門戶)遞交,,參考成員國(RMS)主導(dǎo)審評,eCTD需支持多國同步評估的模塊化拆分,。 互認(rèn)程序(MRP):已授權(quán)成員國作為RMS,,eCTD需包含基線序列(Baseline Sequence 0000)以整合歷史審評數(shù)據(jù),并通過CMDh協(xié)調(diào)分歧,。美國ANDA注冊申報(bào)相關(guān)技術(shù)支持,。黑龍江eCTD歡迎選購
中NDA注冊申報(bào)相關(guān)技術(shù)支持。黑龍江eCTD歡迎選購
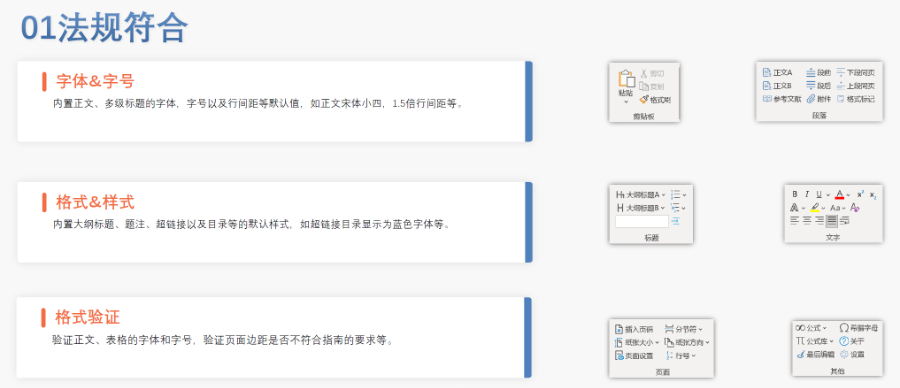
歐盟eCTD的遞交途徑與技術(shù)要求 不同審評程序?qū)?yīng)不同遞交渠道:集中程序(CP)通過EMA的eSubmission Gateway或Web Client提交,,分散程序(DCP)和互認(rèn)程序(MRP)則需使用歐盟通用提交門戶(CESP),。文件結(jié)構(gòu)需嚴(yán)格遵循模塊化要求,例如CEP申請需包含模塊1(行政文件),、模塊2(質(zhì)量概述)和模塊3(技術(shù)文檔),,且XML主干文件須符合EDQM的特定命名規(guī)則。此外,,所有PDF文件需無密碼保護(hù),、可全文檢索,并嵌入層級書簽以支持快速審閱,。 CEP申請的eCTD遞交特殊性 CEP程序自2018年起強(qiáng)制采用eCTD格式,,重點(diǎn)評估原料藥是否符合歐洲藥典標(biāo)準(zhǔn)。其模塊1需包含EDQM申請表,、簡歷及變更說明表,,模塊2需使用EDQM提供的質(zhì)量概述模板,模塊3則按CTD格式組織3.2.S章節(jié)內(nèi)容,。CEP與ASMF(活性物質(zhì)主文件)的主要區(qū)別在于性:CEP無需關(guān)聯(lián)上市許可,,且審評由EDQM完成。黑龍江eCTD歡迎選購