江蘇INDeCTD 創(chuàng)新服務(wù) 賦悅科技供應(yīng)
發(fā)貨地點(diǎn):浙江省杭州市
發(fā)布時(shí)間:2025-04-30
發(fā)貨地點(diǎn):浙江省杭州市
發(fā)布時(shí)間:2025-04-30
危機(jī)應(yīng)對(duì)與應(yīng)急遞交機(jī)制 在公共衛(wèi)生緊急事件(如COVID-19)中,EMA允許簡(jiǎn)化eCTD序列,,優(yōu)先審評(píng)關(guān)鍵模塊并暫緩非數(shù)據(jù),。申請(qǐng)人可通過(guò)快速通道(Fast Track)提交疫苗或藥物的eCTD資料,審評(píng)周期可壓縮至6個(gè)月,。此類(lèi)申請(qǐng)需附風(fēng)險(xiǎn)評(píng)估報(bào)告,,并承諾后續(xù)補(bǔ)交完整數(shù)據(jù)。 數(shù)據(jù)安全與長(zhǎng)期存檔 歐盟要求eCTD資料存檔期限至少為藥品上市后30年,,EMA采用分布式存儲(chǔ)和區(qū)塊鏈技術(shù)確保數(shù)據(jù)不可篡改,。申請(qǐng)人需定期備份本地副本,并使用符合GDPR要求的加密傳輸協(xié)議(如AS2)遞交,。歷史數(shù)據(jù)的遷移和格式轉(zhuǎn)換(如NeeS轉(zhuǎn)eCTD)需遵循特定技術(shù)規(guī)范,。 環(huán)保效益與可持續(xù)發(fā)展 eCTD取代紙質(zhì)遞交后,歐盟每年減少約500噸紙張消耗,,審評(píng)流程的數(shù)字化降低碳足跡約30%,。虛擬審評(píng)會(huì)議和電子簽名進(jìn)一步減少了差旅需求,契合歐盟2050碳中和目標(biāo),。未來(lái),,eCTD4.0將通過(guò)數(shù)據(jù)壓縮技術(shù)進(jìn)一步降低服務(wù)器能耗,。澳大利亞eCTD驗(yàn)證標(biāo)準(zhǔn)相關(guān)技術(shù)支持。江蘇INDeCTD
歐美eCTD實(shí)施經(jīng)驗(yàn)豐富,,中國(guó)可借鑒以加速進(jìn)程,。中國(guó)可能會(huì)經(jīng)歷從企業(yè)自愿eCTD提交到強(qiáng)制eCTD提交的過(guò)渡,且將緊隨ICH步伐,,尤其在CMC資料整理方面,。全球正向eCTD 4.0過(guò)渡,中國(guó)也不例外,,將隨日本,、歐盟、美國(guó)等強(qiáng)制實(shí)施而逐步推進(jìn),。 中國(guó)崛起帶來(lái)全球化競(jìng)爭(zhēng)機(jī)會(huì),,eCTD實(shí)施將助力中國(guó)企業(yè)走向世界。技術(shù)進(jìn)步將加速eCTD實(shí)施,,企業(yè)需密切關(guān)注技術(shù)動(dòng)態(tài),,調(diào)整戰(zhàn)略。隨著國(guó)內(nèi)就業(yè)壓力增大和企業(yè)出海需求增加,,了解eCTD等國(guó)際標(biāo)準(zhǔn)將成為職業(yè)發(fā)展的重要競(jìng)爭(zhēng)力,。 中國(guó)推進(jìn)eCTD需面對(duì)特色問(wèn)題,如上市后申請(qǐng)資料匹配,,需企業(yè)與監(jiān)管機(jī)構(gòu)共同解決,。基線(xiàn)要求是關(guān)鍵,,中國(guó)需制定適合國(guó)情的要求,。期待未來(lái)執(zhí)行指南既具特色又與國(guó)際接軌,為eCTD實(shí)施提供支持,。上海生物制品eCTD性?xún)r(jià)比瑞士NDA注冊(cè)申報(bào)相關(guān)技術(shù)支持,。
美國(guó)eCTD的強(qiáng)制實(shí)施時(shí)間與范圍:美國(guó)自2017年5月5日起要求藥申請(qǐng)(NDA)、仿制藥申請(qǐng)(ANDA)和生物制品許可申請(qǐng)(BLA)必須通過(guò)eCTD格式提交,,2018年5月5日進(jìn)一步擴(kuò)展至臨床試驗(yàn)申請(qǐng)(IND)和藥品主文件(DMF),。FDA通過(guò)《聯(lián)邦食品、藥品和化妝品法案》第745A條明確電子提交的強(qiáng)制性,,豁免非商業(yè)化IND和部分DMF類(lèi)型(如Ⅲ類(lèi)),。2023年數(shù)據(jù)顯示,F(xiàn)DA接收的eCTD申請(qǐng)占比已達(dá)92%,,標(biāo)志著電子化審評(píng)體系的成熟,。企業(yè)若未按規(guī)范提交(如缺少u(mài)s-regional.xml文件或重復(fù)序列號(hào)),將直接被拒收,。
DMF維護(hù)與合規(guī) 年度更 即使無(wú)變更,,每年需提交聲明,;重大工藝/設(shè)施變更需及時(shí)通知客戶(hù)并更文件,。 現(xiàn)場(chǎng)檢查 原料藥企業(yè)需通過(guò)FDA現(xiàn)場(chǎng)檢查,,驗(yàn)證是否符合ICH Q7 GMP標(biāo)準(zhǔn),并與DMF內(nèi)容一致,。 轉(zhuǎn)讓與關(guān)閉 轉(zhuǎn)讓?zhuān)盒钑?shū)面通知FDA并提供持有者信息,。 關(guān)閉:未提交年度報(bào)告或持有人主動(dòng)申請(qǐng),需說(shuō)明原因并通知所有授權(quán)方,。 關(guān)鍵注意事項(xiàng) 數(shù)據(jù)質(zhì)量:所有資料需準(zhǔn)確,、完整,減少審核延遲風(fēng)險(xiǎn),。 合規(guī)性:遵循FDA指南(如21 CFR Part 207)及USP標(biāo)準(zhǔn)(如培養(yǎng)基物料來(lái)源級(jí)別),。 溝通機(jī)制:建議通過(guò)專(zhuān)業(yè)機(jī)構(gòu)(如瑞歐佰藥)協(xié)助,定期提交周報(bào)并制定計(jì)劃表以提高效率,。 常見(jiàn)問(wèn)題解答 生物制品分類(lèi):培養(yǎng)基,、外泌體等均屬Ⅱ類(lèi)DMF。 質(zhì)量標(biāo)準(zhǔn):參考USP及同行標(biāo)準(zhǔn),,需提供分析方法驗(yàn)證及雜質(zhì)對(duì)比研究,。 周期估算:資料準(zhǔn)備約5-50個(gè)工作日,總周期受缺陷回復(fù)影響,。瑞士IND注冊(cè)申報(bào)相關(guān)技術(shù)支持,。
中國(guó)將進(jìn)一步與國(guó)際接軌,推進(jìn)eCTD等標(biāo)準(zhǔn)應(yīng)用,,提高藥品注冊(cè)效率和質(zhì)量,。AI技術(shù)可能在藥品注冊(cè)領(lǐng)域廣泛應(yīng)用,如輔助審評(píng)人員工作,。未來(lái)藥品注冊(cè)資料將更注重結(jié)構(gòu)化數(shù)據(jù),,有助于監(jiān)管機(jī)構(gòu)高效獲取和利用數(shù)據(jù)。 eCTD等數(shù)字化工具將推動(dòng)藥品監(jiān)管向智慧監(jiān)管和全生命周期監(jiān)管發(fā)展,,提高監(jiān)管效率和質(zhì)量,。區(qū)塊鏈技術(shù)具有應(yīng)用前景,可構(gòu)建全球統(tǒng)一的藥品申報(bào)數(shù)據(jù)平臺(tái),。數(shù)據(jù)化時(shí)代,,藥品注冊(cè)領(lǐng)域?qū)⒏⒅財(cái)?shù)據(jù)收集、分析和利用,,為監(jiān)管機(jī)構(gòu)和企業(yè)提供決策支持,。 總而言之,展望未來(lái),,隨著eCTD在藥品注冊(cè)領(lǐng)域的廣泛應(yīng)用和不斷發(fā)展,,中國(guó)將逐步建立起與國(guó)際接軌的藥品注冊(cè)體系,。這將有助于提高中國(guó)藥品注冊(cè)的效率和質(zhì)量,推動(dòng)中國(guó)藥品走向世界舞臺(tái),。同時(shí),,企業(yè)也需要密切關(guān)注技術(shù)發(fā)展動(dòng)態(tài)和監(jiān)管政策變化,及時(shí)調(diào)整自身戰(zhàn)略和規(guī)劃,,以適應(yīng)未來(lái)的市場(chǎng)競(jìng)爭(zhēng)和監(jiān)管要求,。加拿大DMF注冊(cè)申報(bào)關(guān)技術(shù)支持。浙江仿制藥eCTD服務(wù)電話(huà)
澳大利亞NDA注冊(cè)申報(bào)相關(guān)技術(shù)支持,。江蘇INDeCTD
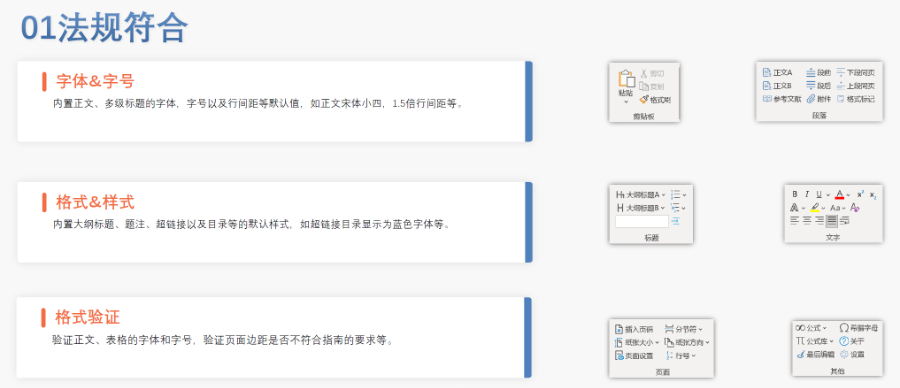
法規(guī)文檔管理系統(tǒng) 協(xié)同共享 RDMS可以讓跨區(qū)域,、跨部門(mén)協(xié)同真正成為1+1>2的 工作。讓頻繁的文檔共享傳輸,,版本管理,,生命周 期審批都變得輕松簡(jiǎn)單 安全合規(guī) 通過(guò)詳細(xì)的審計(jì)追蹤、電子簽名,、權(quán)限管理,、網(wǎng) 關(guān)控制、頁(yè)面控制等技術(shù)手段,,構(gòu)建安全合規(guī)的 文檔管理系統(tǒng),,通過(guò)安全驗(yàn)證與合規(guī)驗(yàn)證 統(tǒng)一文檔來(lái)源 藥品注冊(cè)是企業(yè)經(jīng)營(yíng)成果的技術(shù)資料,由多個(gè)部門(mén) 長(zhǎng)時(shí)間匯集到法規(guī)部門(mén),。RDMS確保多部門(mén)文檔來(lái) 源統(tǒng)一,,即使人員流動(dòng)也可以快速接續(xù)工作 統(tǒng)一文檔結(jié)構(gòu) 根據(jù)不同申報(bào)類(lèi)型,自動(dòng)生成文檔結(jié)構(gòu),,讓法規(guī) 人員與跨部門(mén)同事掌握申報(bào)需要的資料需求,,降 低溝通成本,降低經(jīng)驗(yàn)需求,,避免疏忽遺漏江蘇INDeCTD