-
智能檢測(cè)技術(shù)在線路板生產(chǎn)中的應(yīng)用
-
半導(dǎo)體封裝技術(shù)與線路板的結(jié)合
-
微型化趨勢(shì)對(duì)線路板設(shè)計(jì)的影響
-
線路板回收技術(shù)的發(fā)展現(xiàn)狀
-
PCB高頻材料在高頻線路板中的重要性
-
工業(yè) 4.0 背景下線路板制造的轉(zhuǎn)型
-
PCB柔性線路板技術(shù)的進(jìn)展
-
全球供應(yīng)鏈變動(dòng)對(duì)線路板行業(yè)的影響
-
AI 技術(shù)在線路板生產(chǎn)中的應(yīng)用
-
PCB新能源汽車對(duì)線路板技術(shù)的影響
上海港免疫診斷試劑進(jìn)出口許可證辦理
進(jìn)口生物試劑的企業(yè)必須具備特定資質(zhì)。首先,,企業(yè)需完成對(duì)外貿(mào)易經(jīng)營者備案登記,獲得合法進(jìn)出口經(jīng)營權(quán),。若進(jìn)口藥品類生物試劑,,應(yīng)持有有效的藥品經(jīng)營許可證,其倉儲(chǔ),、運(yùn)輸?shù)仍O(shè)施要符合藥品經(jīng)營質(zhì)量管理規(guī)范(GSP),,確保試劑儲(chǔ)存與流通環(huán)節(jié)質(zhì)量可控。對(duì)于醫(yī)療器械類生物試劑進(jìn)口,,企業(yè)需依據(jù)試劑風(fēng)險(xiǎn)等級(jí),,完成醫(yī)療器械經(jīng)營備案或取得醫(yī)療器械經(jīng)營許可證。企業(yè)還應(yīng)配備專業(yè)人員,,包括熟悉生物試劑法規(guī),、質(zhì)量控制及進(jìn)口業(yè)務(wù)流程的管理人員與技術(shù)人員,以滿足進(jìn)口業(yè)務(wù)的專業(yè)操作與合規(guī)管理需求,。對(duì)于生物試劑出口,,要熟悉進(jìn)口國的貿(mào)易壁壘政策。上海港免疫診斷試劑進(jìn)出口許可證辦理

隨著科技發(fā)展,,新興技術(shù)在生物試劑進(jìn)出口領(lǐng)域普遍應(yīng)用,。在質(zhì)量檢測(cè)方面,基因測(cè)序技術(shù)用于精確檢測(cè)生物試劑中 DNA,、RNA 等生物分子的序列,,能快速準(zhǔn)確鑒定試劑的純度和特性,相比傳統(tǒng)檢測(cè)方法更高效,、精細(xì),。在運(yùn)輸環(huán)節(jié),物聯(lián)網(wǎng)技術(shù)發(fā)揮重要作用,,通過在冷鏈運(yùn)輸設(shè)備上安裝傳感器,,實(shí)時(shí)采集溫度、濕度等數(shù)據(jù),,并上傳至監(jiān)控平臺(tái),,企業(yè)可隨時(shí)掌握運(yùn)輸狀態(tài),一旦出現(xiàn)異常能及時(shí)采取措施,,確保生物試劑在適宜條件下運(yùn)輸,。此外,,3D 打印技術(shù)也開始應(yīng)用于定制化生物試劑包裝,可根據(jù)試劑特殊形狀和防護(hù)需求,,快速制作個(gè)性化包裝,,提高包裝的適配性和防護(hù)效果,助力生物試劑進(jìn)出口業(yè)務(wù)的高效發(fā)展,。無錫生物試劑進(jìn)出口檢驗(yàn)檢疫生物試劑進(jìn)口申報(bào)需提供產(chǎn)品的第三方檢測(cè)報(bào)告,。
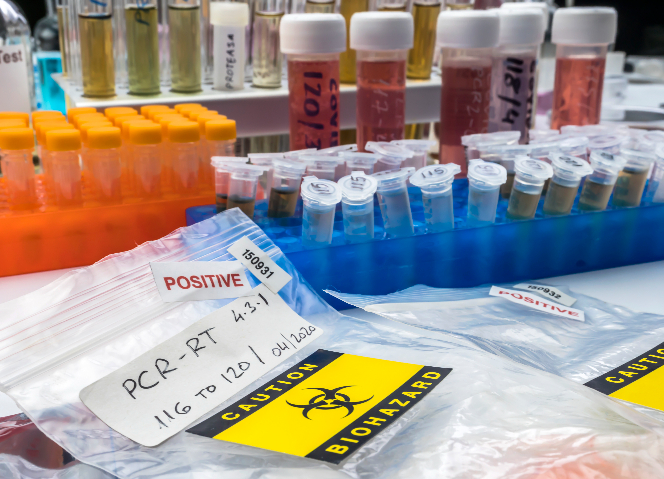
對(duì)于特殊生物制品類生物試劑,如疫苗類,、血液制品類及血源篩查用診斷試劑等,,進(jìn)口審批更為嚴(yán)格。進(jìn)口企業(yè)必須提前向國家藥品監(jiān)督管理局申請(qǐng)進(jìn)口批件,。申請(qǐng)時(shí),,需提供產(chǎn)品的詳細(xì)信息,包括生產(chǎn)工藝,、質(zhì)量標(biāo)準(zhǔn),、穩(wěn)定性研究數(shù)據(jù)、臨床使用情況等資料,,以證明產(chǎn)品質(zhì)量可靠,、安全有效且符合國內(nèi)需求。國家藥品監(jiān)督管理局會(huì)組織人員對(duì)申請(qǐng)資料進(jìn)行多方面審評(píng),,只有在獲得進(jìn)口批件后,,企業(yè)才具備此類生物試劑的進(jìn)口資格,防止不合格或高風(fēng)險(xiǎn)特殊生物制品流入國內(nèi),。
特殊生物試劑進(jìn)口有著更為嚴(yán)苛的政策,。高風(fēng)險(xiǎn)生物制品類試劑,如某些用于血液篩查的診斷試劑,,除滿足常規(guī)進(jìn)口要求外,,還需依據(jù)《生物制品批簽發(fā)管理辦法》,在進(jìn)口前取得生物制品批簽發(fā)證明,,確保每批次產(chǎn)品質(zhì)量安全,。涉及人類遺傳資源的生物試劑進(jìn)口,受《中華人民共和國人類遺傳資源管理?xiàng)l例》監(jiān)管,,進(jìn)口單位需提前申請(qǐng)人類遺傳資源許可,,防止我國人類遺傳資源非法外流,同時(shí)保證試劑用于合法科研,、醫(yī)療等用途,。此外,對(duì)于含有毒有害物質(zhì)或受管控生物因子的生物試劑,需符合環(huán)保,、生物安全等多部門聯(lián)合制定的進(jìn)口政策,,履行相應(yīng)審批與監(jiān)管流程。生物試劑進(jìn)口過程中,,需提前辦理目的國要求的進(jìn)口許可證,。

生物試劑進(jìn)出口領(lǐng)域存在多種國際合作模式。一種是跨國企業(yè)間的聯(lián)合研發(fā)合作,,例如歐美藥企與亞洲生物試劑企業(yè)合作,,利用歐美企業(yè)的研發(fā)資金和技術(shù)優(yōu)勢(shì),結(jié)合亞洲企業(yè)的人力成本與市場(chǎng)資源,,共同開發(fā)新型生物試劑,,研發(fā)成果通過雙方進(jìn)出口渠道推向全球市場(chǎng)。另一種是技術(shù)授權(quán)合作模式,,擁有先進(jìn)生物試劑技術(shù)的企業(yè)將技術(shù)授權(quán)給其他國家企業(yè),被授權(quán)企業(yè)負(fù)責(zé)本地化生產(chǎn)與銷售,,技術(shù)授權(quán)方則通過收取授權(quán)費(fèi)和銷售分成獲利,,促進(jìn)生物試劑技術(shù)在國際間流動(dòng)與產(chǎn)品進(jìn)出口。還有產(chǎn)業(yè)園區(qū)合作模式,,不同國家共建生物產(chǎn)業(yè)園區(qū),,園區(qū)內(nèi)企業(yè)共享資源、技術(shù)和市場(chǎng),,在生物試劑進(jìn)出口方面形成產(chǎn)業(yè)集群優(yōu)勢(shì),,提升整體國際競(jìng)爭(zhēng)力,推動(dòng)生物試劑進(jìn)出口業(yè)務(wù)協(xié)同發(fā)展,。生物試劑進(jìn)口需關(guān)注目的國對(duì)生物試劑使用人群的限定,。上海港細(xì)胞培養(yǎng)試劑進(jìn)出口審批單代辦
進(jìn)行生物試劑出口,應(yīng)選擇具備生物運(yùn)輸資質(zhì)的國際物流,。上海港免疫診斷試劑進(jìn)出口許可證辦理
進(jìn)出口的生物試劑必須符合目標(biāo)市場(chǎng)的質(zhì)量與安全標(biāo)準(zhǔn),。在出口環(huán)節(jié),產(chǎn)品要多方面滿足進(jìn)口國法規(guī)及相關(guān)國際標(biāo)準(zhǔn),。以出口歐盟的生物試劑為例,,其必須符合歐盟指令與協(xié)調(diào)標(biāo)準(zhǔn),通過 CE 認(rèn)證,,該認(rèn)證涵蓋產(chǎn)品安全性,、健康影響、環(huán)保等多方面評(píng)估,,只有順利通過認(rèn)證機(jī)構(gòu)檢測(cè)與審核,,獲得認(rèn)證證書,產(chǎn)品才能在歐盟市場(chǎng)流通,。出口美國則要符合美國食品藥品監(jiān)督管理局(FDA)要求并完成相應(yīng)注冊(cè)程序,,如醫(yī)療器械類生物試劑可能需進(jìn)行 510 (k) 申請(qǐng)或上市前批準(zhǔn)(PMA)等,。進(jìn)口生物試劑時(shí),需確保其符合我國藥品,、醫(yī)療器械等相關(guān)法規(guī),,例如藥品類生物試劑要符合我國藥品注冊(cè)標(biāo)準(zhǔn),從藥品的成分,、純度到穩(wěn)定性等各方面都有細(xì)致規(guī)定,;醫(yī)療器械類生物試劑要通過國內(nèi)注冊(cè)或備案,產(chǎn)品的研發(fā),、生產(chǎn),、質(zhì)量控制等環(huán)節(jié)都要達(dá)到對(duì)應(yīng)規(guī)范,否則產(chǎn)品將無法順利通關(guān),,更無法進(jìn)入市場(chǎng)銷售,,還可能面臨召回、處罰等風(fēng)險(xiǎn),。上海港免疫診斷試劑進(jìn)出口許可證辦理
- 上海倉庫放行時(shí)間 2025-06-09
- 上海海關(guān)監(jiān)管倉儲(chǔ)哪家靠譜 2025-06-09
- 蘇州酶類試劑進(jìn)出口運(yùn)輸 2025-06-08
- 酶類試劑進(jìn)出口許可證辦理 2025-06-08
- 蘇州酶類試劑進(jìn)出口檢驗(yàn)檢疫 2025-06-08
- 上海港酶類試劑進(jìn)出口檢驗(yàn)檢疫 2025-06-08
- 無錫抗體試劑進(jìn)出口審批單 2025-06-08
- 上海港免疫診斷試劑進(jìn)出口許可證辦理 2025-06-08
- 細(xì)胞培養(yǎng)試劑進(jìn)出口檢驗(yàn)檢疫 2025-06-08
- 上海港保稅監(jiān)管倉儲(chǔ)物流 2025-06-08
- 金華電子物料電子料倉wms系統(tǒng) 2025-06-09
- 浙江激光切割機(jī)物流倉儲(chǔ)貨物門對(duì)門服務(wù) 2025-06-09
- 蘇州服務(wù)觀光車 2025-06-09
- 湖北不銹鋼手推車供應(yīng)商 2025-06-09
- 清遠(yuǎn)到美國海運(yùn)專線公司 2025-06-09
- 湖北什么倉儲(chǔ)托管市場(chǎng)報(bào)價(jià) 2025-06-09
- 廣州到休斯頓海運(yùn)專線合作 2025-06-09
- 河北海派美國專線服務(wù)商 2025-06-09
- 智能FBA換標(biāo)一站式服務(wù)商 2025-06-09
- 宜興哪里有人臉識(shí)別 2025-06-09