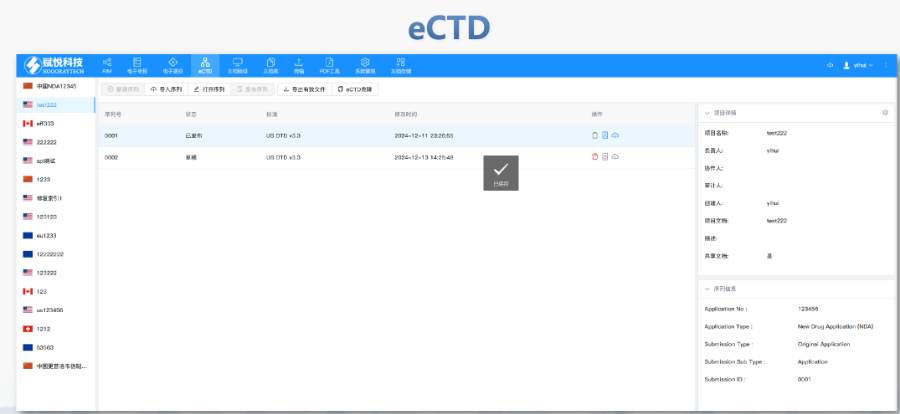
浦東新區(qū)CDE eCTD文件如何制作
美國于2003年成為全球早采用eCTD(電子通用技術(shù)文檔)的國家之一,初由CDER和CBER作為電子提交平臺試點,。2008年起,eCTD正式成為藥申請(NDA)和生物制品許可申請(BLA)的標準格式,,并在2012年通過《藥申報者付費法案》(PDUFA)進一步強化其法律地位。至2017年,,F(xiàn)DA強制要求所有藥申請(NDA),、簡略藥申請(ANDA)及藥物主文件(DMF)必須采用eCTD格式提交,,標志著其從可選到強制的轉(zhuǎn)型,。這一進程在2018年擴展至臨床試驗申請(IND),終實現(xiàn)全類型藥品注冊的電子化覆蓋美國eCTD注冊咨詢相關(guān)技術(shù)支持。浦東新區(qū)CDE eCTD文件如何制作
歐盟eCTD的歷史沿革與強制實施 歐盟自2003年逐步推進eCTD(電子通用技術(shù)文檔)的標準化進程,初要求藥注冊申請(MAA)采用CTD格式,。2010年,集中審評程序(CP)率先強制使用eCTD,隨后分散程序(DCP)和互認程序(MRP)分別于2015年,、2017年跟進,。至2019年,歐盟要求所有國家程序(NP)的注冊申請均以eCTD格式提交,標志著其電子遞交體系的成熟,。2024年,EMA啟動eCTD4.0試點項目,,旨在提升技術(shù)兼容性與審評效率。 eCTD驗證標準的迭代與關(guān)鍵更 歐盟的驗證標準歷經(jīng)多次調(diào)整,,例如2025年3月啟用的eCTD3.1區(qū)域模板和驗證規(guī)則v8.1,對文件結(jié)構(gòu),、元數(shù)據(jù)和內(nèi)容完整性提出更嚴格的要求,。標準引入的“追蹤表(Tracking Table)”強制校驗規(guī)則(如15.11和15.12)曾導致CEP(歐洲藥典適用性證書)遞交,,后通過允許占位文件臨時解決。與早期版本相比,,v8.1強化了對模塊一區(qū)域信息的邏輯驗證,并細化了對PDF書簽,、超鏈接的規(guī)范性檢查,。eCTD是什么加拿大eCTD注冊外包相關(guān)技術(shù)支持。
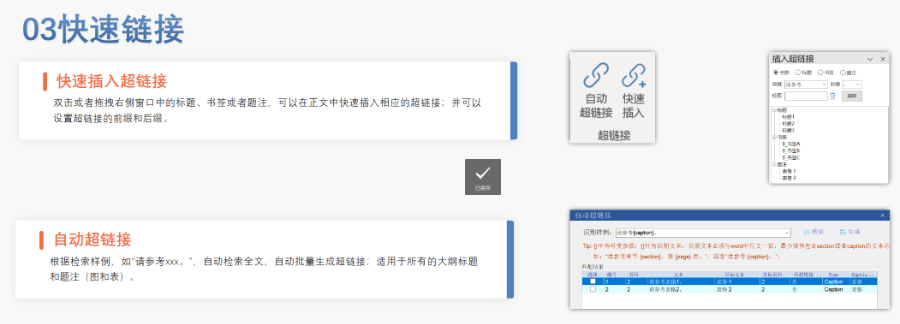
美國電子提交通道ESG(Electronic Submissions Gateway)是美國食品藥品監(jiān)督管理局(FDA)建立的電子化監(jiān)管信息提交系統(tǒng),,旨在為制藥,、生物制品、醫(yī)療器械等行業(yè)提供安全,、高效的電子申報服務(wù)。自2006年啟用以來,ESG已成為FDA接收電子監(jiān)管材料的入口,,每日處理上千份提交文件,涵蓋上市前審批,、上市后監(jiān)管,、臨床試驗數(shù)據(jù),、不良反應(yīng)報告等多種類型。該系統(tǒng)通過數(shù)字證書加密和公鑰基礎(chǔ)設(shè)施(PKI)技術(shù),,確保文件傳輸?shù)恼鎸嵭?、完整性和不可否認性,符合FDA對電子提交的嚴格合規(guī)要求,。在技術(shù)層面,,ESG具備強大的文件處理能力,。2018年系統(tǒng)升級后,,取消了單個文件8GB的限制,,可支持高達35GB的大型文件提交,進一步滿足復雜申報需求,。此外,,文件格式需遵循eCTD(電子通用技術(shù)文檔)規(guī)范,包括模塊化結(jié)構(gòu),、PDF標準化和XML元數(shù)據(jù)整合,,以確保全球監(jiān)管機構(gòu)兼容性,。2025年3月28日起,F(xiàn)DA將啟用新一代平臺ESG NextGen,,逐步替代現(xiàn)有系統(tǒng),,過渡期需關(guān)注兼容性和穩(wěn)定性問題。
緊急申報與特殊通道:FDA設(shè)置緊急申報通道(如Pre-EUA和EUA),允許在公共衛(wèi)生事件中快速提交資料。此類申請需在模塊1.19注明特殊標識,,并通過ESG加急處理。 eCTD版本兼容性與過渡策略:eCTD 4.0支持向前兼容,允許v3.2.2文件無縫過渡,。企業(yè)需在2024年前完成系統(tǒng)升級,,確保XML到HL7 RPS的格式轉(zhuǎn)換。過渡期間需同時維護舊版本系統(tǒng),。 區(qū)域差異與全球化協(xié)調(diào):美國模塊1要求嚴格,如UUID標識符和組合申請支持,而歐盟側(cè)重文件引用合規(guī)性,。FDA與PMDA,、EMA通過ICH框架協(xié)調(diào)eCTD標準,,但區(qū)域特殊性仍需針對性適配,。 行業(yè)影響與長期價值:eCTD不是技術(shù)升級,更是全球藥品監(jiān)管一體化的驅(qū)動力。其標準化,、可追溯性和效率提升,,推動了跨國多中心試驗的協(xié)同申報,加速創(chuàng)藥上市進程。歐盟eCTD注冊外包相關(guān)技術(shù)支持,。
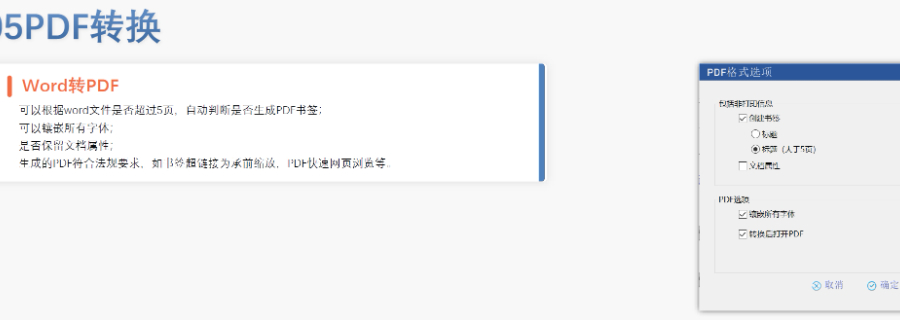
eCTD的技術(shù)架構(gòu)與模塊要求:美國eCTD基于XML技術(shù),,嚴格遵循ICH M4框架,,分為5個模塊:模塊1(地區(qū)行政信息),、模塊2(技術(shù)總結(jié)),、模塊3-5(質(zhì)量,、非臨床與臨床數(shù)據(jù))。其中,,模塊1需包含F(xiàn)DA特定的文件,,涵蓋申請編號,、聯(lián)系人和DMF授權(quán)書等行政信息,。模塊2-5需與ICH CTD全球統(tǒng)一標準一致,,但FDA對文件顆粒度要求更細,,例如非臨床研究報告需拆分并標記Study ID。PDF文件需符合FDA v4.1格式規(guī)范,,包括字體嵌入,、書簽層級和超鏈接功能,。澳大利亞eCTD申報軟件相關(guān)技術(shù)支持。徐匯區(qū)INDeCTD銷售電話
eCTD注冊外包相關(guān)技術(shù)支持,。浦東新區(qū)CDE eCTD文件如何制作
歐洲藥品管理局:集中審評程序由歐洲藥品管理局(European Medicines Agency, EMA)負責協(xié)調(diào)。 人用藥品委員會:人用藥品委員會(Committee for Medicinal Products for Human Use, CHMP)負責提供科學意見,。 歐盟委員會:CHMP的意見隨后被提交給歐盟委員會(European Commission, EC),,由歐盟委員會做出是否授權(quán)的終決定。這個決定在整個歐盟都是具有法律約束力的。 審批過程: 申請人向EMA提交申請,,包括eCTD(電子通用技術(shù)文檔)格式的藥品注冊文檔。 EMA的CHMP分配一個科學評估團隊(Rapporteur和Co-Rapporteur),,負責初步評估,。 CHMP基于評估團隊的報告提供科學意見,。 歐盟委員會根據(jù)CHMP的意見做出終決定,,批準或拒絕藥品上市。 授權(quán)范圍 如果藥品獲得批準,,將獲得在整個歐盟,、冰島、列支敦士登和挪威有效的上市許可(Central Marketing Authorisation, CMA),。浦東新區(qū)CDE eCTD文件如何制作
賦悅科技(杭州)有限責任公司在同行業(yè)領(lǐng)域中,一直處在一個不斷銳意進取,,不斷制造創(chuàng)新的市場高度,多年以來致力于發(fā)展富有創(chuàng)新價值理念的產(chǎn)品標準,,在浙江省等地區(qū)的數(shù)碼,、電腦中始終保持良好的商業(yè)口碑,,成績讓我們喜悅,但不會讓我們止步,,殘酷的市場磨煉了我們堅強不屈的意志,和諧溫馨的工作環(huán)境,,富有營養(yǎng)的公司土壤滋養(yǎng)著我們不斷開拓創(chuàng)新,勇于進取的無限潛力,,賦悅科技供應(yīng)攜手大家一起走向共同輝煌的未來,回首過去,,我們不會因為取得了一點點成績而沾沾自喜,,相反的是面對競爭越來越激烈的市場氛圍,,我們更要明確自己的不足,做好迎接新挑戰(zhàn)的準備,,要不畏困難,,激流勇進,以一個更嶄新的精神面貌迎接大家,,共同走向輝煌回來,!
- 高新區(qū)中國eCTD歡迎選購 2025-05-14
- 靜安區(qū)生物制品eCTD使用 2025-05-14
- 蕪湖新藥eCTD是什么 2025-05-14
- 吳江區(qū)賦悅科技eCTD供應(yīng)商 2025-05-14
- 南京生物制品eCTD注冊系統(tǒng) 2025-05-14
- 上海化學藥品eCTD格式 2025-05-09
- 南京電子申報eCTD哪個品牌好 2025-05-09
- 太倉NDAeCTD服務(wù)價格 2025-05-09
- 浦東新區(qū)原料藥eCTD文件如何制作 2025-04-26
- 南京新藥eCTD找哪家 2025-04-26
- 遵義高效轉(zhuǎn)化率提升價格 2025-06-06
- solarflare X2522 或X2541PLUS超頻服務(wù)器哪里好 2025-06-06
- 黑龍江高性能手持平板哪家強 2025-06-06
- 數(shù)智家庭農(nóng)場erp哪個好 2025-06-06
- 重慶碳鋼矩陣柔性夾具廠家直銷 2025-06-06
- 蘇州購買智慧醫(yī)療設(shè)計 2025-06-06
- 長沙藍牙超高頻讀寫器工作原理 2025-06-06
- 天津移動硬盤價格 2025-06-06
- 廣州單目攝像頭模組多少錢 2025-06-06
- 浙江蘋果電腦測試設(shè)備優(yōu)缺點 2025-06-06