浦東新區(qū)藥品注冊eCTD服務價格
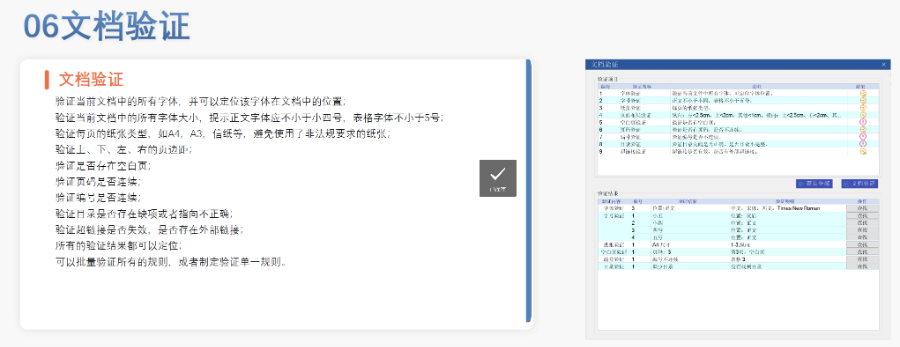
eCTD文件制作需遵循嚴格的法規(guī)要求和標準化流程,,以下是關鍵要點整理:eCTD采用模塊化結構,包含模塊1(行政信息)至模塊5(臨床報告),,需按ICH和監(jiān)機構要求構建目錄樹,。顆粒度選擇:文件提交層級需在***申報時確定并沿用,例如原料和制劑的章節(jié)(如,、)需按比較低顆粒度拆分,,輔料單獨成章。PDF需添加書簽(導航目錄)和超鏈接(跨網(wǎng)頁跳轉),,超過5頁的文件必須包含目錄(TOC/LOT/LOF),。技術參數(shù):初始視圖需設置默認縮放級別和頁面布局,書簽展開層級不超過三級,,單文件大小需符合申報系統(tǒng)限制,。驗證工具:使用軟件(如BXeCTD)自動生成書簽和超鏈接,并通過序列校驗和PDF校驗功能確保合規(guī)性,。 加拿大eCTD驗證標準相關技術支持,。浦東新區(qū)藥品注冊eCTD服務價格
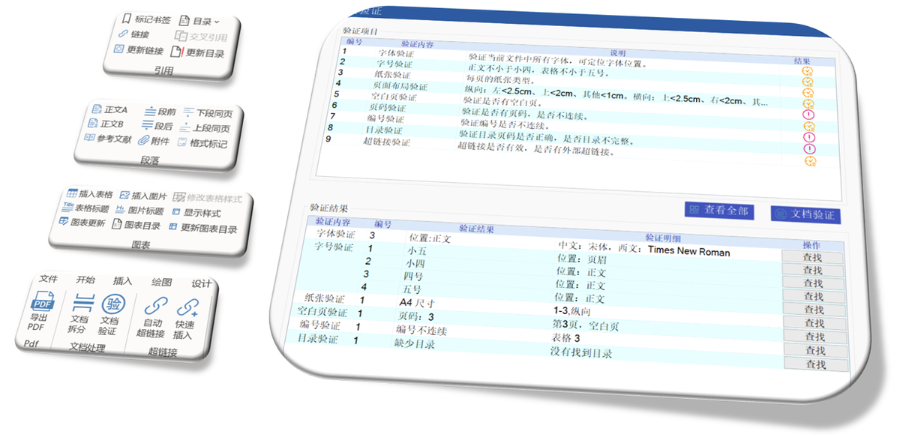
美國eCTD驗證采用三級分類:“錯誤”(必須修正)、“警告”(建議修正),、“提示信息”(參考),。例如,PDF文件版本不符或加密保護屬于“錯誤”,,而書簽路徑非相對性則可能列為“警告”,。驗證失敗將直接導致退審,企業(yè)需通過LORENZ Validator等工具預檢,,確保提交前合規(guī),。 ?技術驗證點 驗證涵蓋XML結構合規(guī)性、文件命名規(guī)則,、生命周期管理(如序列號連續(xù)性)及PDF屬性(如字體嵌入,、可搜索性)。臨床試驗數(shù)據(jù)需額外滿足CDISC標準,,包括SDTM和ADaM數(shù)據(jù)集的結構驗證太倉中國eCTD銷售電話中ANDA注冊申報相關技術支持,。
FDA圍繞eCTD發(fā)布了10余項法規(guī)指南,涵蓋格式要求,、文件生命周期,、數(shù)據(jù)安全等細節(jié),其中《ICH M2 EWG》作為綜合性技術文件,成為企業(yè)申報的參考,。eCTD的實施提升了審評效率,,通過標準化XML結構和電子簽章技術,減少了紙質遞交的物流與時間成本,,同時支持全生命周期管理,,便于后續(xù)變更和補充資料的動態(tài)更。 美國在eCTD實施中注重與ICH國際標準的兼容性,,例如采用統(tǒng)一的CTD模塊化結構和PDF技術規(guī)范,。然而,其區(qū)域性要求(如信封信息中的Application ID,、Submission Subtype)仍體現(xiàn)本土化特色,。這種“國際框架+本地適配”的模式,既保障了跨國藥企的申報便利,,又滿足了FDA的監(jiān)管需求,。
歐洲藥品管理局:集中審評程序由歐洲藥品管理局(European Medicines Agency, EMA)負責協(xié)調。 人用藥品委員會:人用藥品委員會(Committee for Medicinal Products for Human Use, CHMP)負責提供科學意見,。 歐盟委員會:CHMP的意見隨后被提交給歐盟委員會(European Commission, EC),由歐盟委員會做出是否授權的終決定,。這個決定在整個歐盟都是具有法律約束力的,。 審批過程: 申請人向EMA提交申請,包括eCTD(電子通用技術文檔)格式的藥品注冊文檔,。 EMA的CHMP分配一個科學評估團隊(Rapporteur和Co-Rapporteur),,負責初步評估。 CHMP基于評估團隊的報告提供科學意見,。 歐盟委員會根據(jù)CHMP的意見做出終決定,,批準或拒絕藥品上市。 授權范圍 如果藥品獲得批準,,將獲得在整個歐盟,、冰島、列支敦士登和挪威有效的上市許可(Central Marketing Authorisation, CMA),。美國ESG電子提交通道申請相關技術支持,。
eCTD在歐盟藥品監(jiān)管中的歷史背景:歐盟eCTD(電子通用技術文檔)的發(fā)展始于對臨床試驗和藥品審評流程標準化的需求。2001年,,歐盟引入《臨床試驗指令》(CTD)作為統(tǒng)一的法律框架,,但其分散的成員國申報機制導致效率低下。2014年,,歐盟通過《臨床試驗法規(guī)》(CTR, Regulation EU No. 536/2014),,要求通過CTIS平臺(臨床試驗信息系統(tǒng))集中提交臨床試驗申請(CTA),并逐步推動eCTD作為電子化申報的工具。這一旨在解決傳統(tǒng)CTD模式下審評周期長,、多國協(xié)調成本高的問題,,為eCTD的實施奠定了基礎。加拿大eCTD申報軟件相關技術支持,。太倉電子申報eCTD服務價格
中DMF注冊申報相關技術支持,。浦東新區(qū)藥品注冊eCTD服務價格
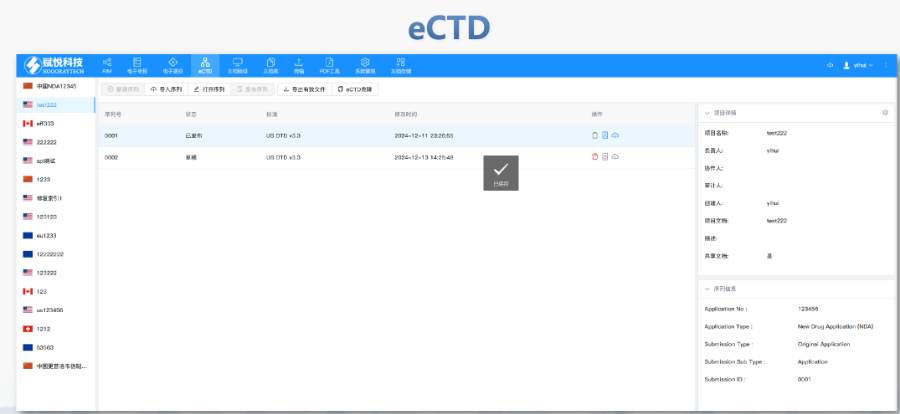
eCTD提交流程與ESG系統(tǒng):FDA要求通過電子提交網(wǎng)關(ESG)傳輸eCTD文件,單個文件大小限制為10GB,,超限需拆分或通過物理介質(如光盤)遞交,。提交前需預分配申請?zhí)枺ㄈ鏝DA編號),并通過ESG測試賬戶驗證技術合規(guī)性,。序列號命名規(guī)則為4位數(shù)字(如0001),,申請需從“原申請”序列開始,補充資料按遞增順序編號,。企業(yè)可自愿提交預審樣本(Pre-Submission),,F(xiàn)DA將反饋文檔結構、元數(shù)據(jù)等合規(guī)性問題,。驗證標準與常見錯誤類型:FDA驗證標準分為高(High),、中(Medium)、低(Low)三級,,高風險錯誤(如無效XML或缺失關鍵表格)必須修復,,否則直接拒收。常見問題包括:重復序列號(錯誤1034),、文件路徑超長(警告2015),、PDF加密或非標字體(錯誤4001)。2023年統(tǒng)計顯示,,30%的提交因模塊1格式錯誤被退回,,凸顯行政信息合規(guī)的重要性。驗證工具如LORENZ eValidator被FDA官方采用,,可自動檢測200+項技術指標,。浦東新區(qū)藥品注冊eCTD服務價格
- 吳江區(qū)國際注冊eCTD 2025-04-20
- 杭州原料藥eCTD 2025-04-19
- 吳江區(qū)生物制品eCTD名稱 2025-04-19
- 河南eCTD注冊系統(tǒng) 2025-04-19
- 山東國內注冊eCTD是什么 2025-04-19
- 南京電子申報eCTD推薦 2025-04-19
- 河北eCTD軟件 2025-04-19
- 寧波國產eCTD服務電話 2025-04-19
- 杭州電子申報eCTD注冊系統(tǒng) 2025-04-19
- 閔行區(qū)生物制品eCTD服務放心可靠 2025-04-19
- 上海智慧城市數(shù)字化生產企業(yè) 2025-04-20
- 嘉定區(qū)品牌軟件服務風格 2025-04-20
- 武漢什么是手機維修價格實惠 2025-04-20
- 國產整合營銷管理模式 2025-04-20
- Exablaze ExaNIC X10或X25超頻服務器銷售廠家 2025-04-20
- 甘肅站臺入侵激光雷達 2025-04-20
- 廣東拍照打印機廠家 2025-04-20
- 宿遷超薄鼓風機品牌 2025-04-20
- 徐州特殊光解膜規(guī)格尺寸 2025-04-20
- 山西特色軟件開發(fā) 2025-04-20