-
航瑞智能助力維尚家具打造自動倉儲系統(tǒng),,實現(xiàn)成品物流智能化升級
-
航瑞智能:準(zhǔn)確把握倉儲痛點,,打造多樣化智能倉儲方案
-
高度集成化自動化立體倉庫:開啟高效物流新時代_航瑞智能
-
探秘倉儲物流中心:輸送機與RGV打造高效智能物流體系
-
共享裝備攜手航瑞智能打造砂芯智能倉儲,實現(xiàn)倉儲物流智能化升級
-
桁架機械手與輸送機:打造高效智能流水線
-
?采用WMS倉庫管理系統(tǒng)能夠給企業(yè)帶來哪些好處,?
-
?航瑞智能:精細把握倉儲痛點,,打造多樣化智能倉儲方案
-
往復(fù)式提升機:垂直輸送系統(tǒng)的智能化解決方案
-
航瑞智能:準(zhǔn)確把握倉儲痛點,打造多樣化智能倉儲方案
杭州原料藥eCTD遞交
eCTD生命周期管理與變更提交:歐盟要求eCTD申報資料覆蓋藥品全生命周期,,包括提交,、補充申請及實質(zhì)性變更。例如,,增成員國需提交“附加成員國序列”,,審評時間約52-83天;重大變更(如生產(chǎn)工藝調(diào)整)需創(chuàng)建序列并通過CTIS平臺更模塊3和模塊1的GMP證明,。技術(shù)驗證工具(如EDQM推薦的檢查軟件)需在每次提交前運行,,確保XML骨架文件與PDF書簽層級符合規(guī)范。此外,,電子簽章需符合《歐盟電子簽名法》,,并在模塊1中明確標(biāo)注法律效力。歐洲通用提交門戶(Common European Submission Portal,,CESP)是歐盟及成員國藥品監(jiān)管機構(gòu)間用于電子化提交申報資料的重要平臺,。以下是關(guān)于CESP的詳細介紹: CESP是由歐盟藥品監(jiān)管部門負責(zé)人網(wǎng)絡(luò)(HMA)合作開發(fā)的在線交付系統(tǒng),旨在為藥品注冊申請者,、利益相關(guān)方和監(jiān)管機構(gòu)之間提供統(tǒng)一,、安全的電子提交通道,。其設(shè)計初衷是簡化跨國申報流程,允許通過單一門戶向多個歐洲國家的藥監(jiān)部門同時提交申請,,避免了重復(fù)操作,。歐盟eCTD驗證標(biāo)準(zhǔn)相關(guān)技術(shù)支持。杭州原料藥eCTD遞交
電子簽章與傳輸安全 文件需經(jīng)AES-256加密后刻錄至不可擦寫光盤,,并附MD5校驗碼,。光盤損壞或病毒污染將觸發(fā)重遞交流程,原載體按銷毀程序處理,。 ?審評與核查協(xié)同 自2018年起,,F(xiàn)DA要求提交兩套光盤分別用于審評和現(xiàn)場核查,2022年調(diào)整為“1套審評+1套核查+1套專項資料”模式,,提升流程效率,。 ?國際化兼容性增強 美國eCTD系統(tǒng)支持與歐盟、日本等地區(qū)的XML互操作性,,但區(qū)域差異(如模塊1的標(biāo)簽要求)仍需人工適配,。 ?未來通道創(chuàng) FDA計劃引入API接口支持企業(yè)系統(tǒng)直連,并探索基于云存儲的實時提交與審評,,減少物理媒介依賴,。無錫CDE eCTD找哪家歐盟CESP提交通道相關(guān)技術(shù)支持。

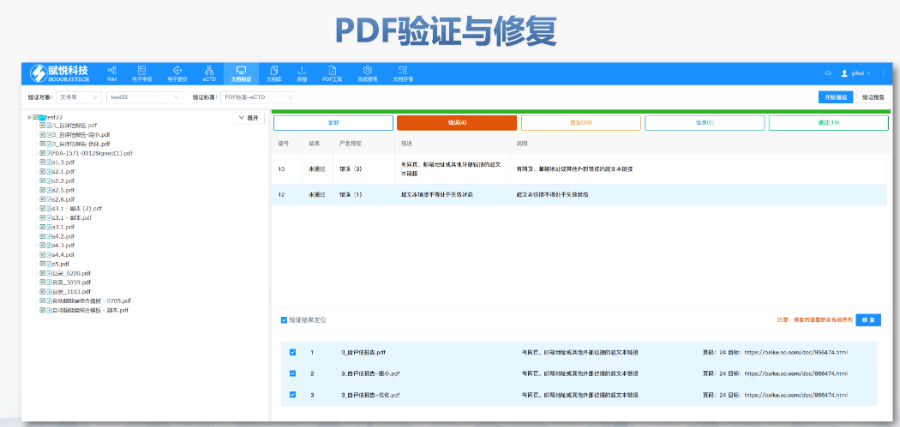
eCTD驗證標(biāo)準(zhǔn)的嚴(yán)格性與分類:歐盟對eCTD的驗證要求分為“錯誤”“警告”和“提示信息”三級,,其中“錯誤”項直接導(dǎo)致申報被拒,。驗證項目涵蓋六大類共149條,包括文件命名規(guī)范(如路徑長度限制),、PDF可讀性(禁止密碼保護),、XML骨架文件完整性等。例如,,文件擴展名必須符合規(guī)范(如.xpt用于臨床數(shù)據(jù)集),,而文件夾層級需避免空目錄或混合存放文件。相較于中國《電子申報驗證標(biāo)準(zhǔn)》的簡化版(54條),,歐盟的驗證體系更為復(fù)雜,,體現(xiàn)了其高標(biāo)準(zhǔn)的技術(shù)監(jiān)管。
區(qū)域化差異與多國協(xié)作挑戰(zhàn) 歐盟eCTD需兼容成員國特定要求,,例如模塊一的行政信息需符合各國語言和法規(guī)差異,。互認(rèn)程序(MRP)中,,參考成員國(RMS)的評估報告需被其他成員國認(rèn)可,,若出現(xiàn)分歧需由CMDh協(xié)調(diào)或提交EMA仲裁。這種多層級審評機制要求申請人在文件準(zhǔn)備階段即考慮區(qū)域兼容性,,避免后續(xù)流程延誤,。 eCTD4.0的探索與未來方向 ICH于2015年發(fā)布的eCTD4.0版本旨在簡化目錄結(jié)構(gòu),、支持多產(chǎn)品類型(如醫(yī)療器械)申報,并增強生命周期管理功能,。歐盟計劃通過2024年試點逐步過渡至4.0,,其扁平化文件組織方式有望減少重復(fù)提交并提升審評效率,。然而,,實施需解決現(xiàn)有系統(tǒng)兼容性及行業(yè)適應(yīng)性問題。歐盟ANDA注冊申報相關(guān)技術(shù)支持,。
美國電子提交通道ESG(Electronic Submissions Gateway)是美國食品藥品監(jiān)督管理局(FDA)建立的電子化監(jiān)管信息提交系統(tǒng),,旨在為制藥、生物制品,、醫(yī)療器械等行業(yè)提供安全,、高效的電子申報服務(wù)。自2006年啟用以來,,ESG已成為FDA接收電子監(jiān)管材料的入口,,每日處理上千份提交文件,涵蓋上市前審批,、上市后監(jiān)管,、臨床試驗數(shù)據(jù)、不良反應(yīng)報告等多種類型,。該系統(tǒng)通過數(shù)字證書加密和公鑰基礎(chǔ)設(shè)施(PKI)技術(shù),,確保文件傳輸?shù)恼鎸嵭浴⑼暾院筒豢煞裾J(rèn)性,,符合FDA對電子提交的嚴(yán)格合規(guī)要求,。在技術(shù)層面,ESG具備強大的文件處理能力,。2018年系統(tǒng)升級后,,取消了單個文件8GB的限制,可支持高達35GB的大型文件提交,,進一步滿足復(fù)雜申報需求,。此外,文件格式需遵循eCTD(電子通用技術(shù)文檔)規(guī)范,,包括模塊化結(jié)構(gòu),、PDF標(biāo)準(zhǔn)化和XML元數(shù)據(jù)整合,以確保全球監(jiān)管機構(gòu)兼容性,。2025年3月28日起,,F(xiàn)DA將啟用新一代平臺ESG NextGen,逐步替代現(xiàn)有系統(tǒng),,過渡期需關(guān)注兼容性和穩(wěn)定性問題,。瑞士eCTD注冊咨詢相關(guān)技術(shù)支持,。上海中國eCTD性價比高
澳大利亞eCTD申報軟件相關(guān)技術(shù)支持。杭州原料藥eCTD遞交
美國于2003年成為全球早采用eCTD(電子通用技術(shù)文檔)的國家之一,,初由CDER和CBER作為電子提交平臺試點,。2008年起,eCTD正式成為藥申請(NDA)和生物制品許可申請(BLA)的標(biāo)準(zhǔn)格式,,并在2012年通過《藥申報者付費法案》(PDUFA)進一步強化其法律地位,。至2017年,F(xiàn)DA強制要求所有藥申請(NDA),、簡略藥申請(ANDA)及藥物主文件(DMF)必須采用eCTD格式提交,,標(biāo)志著其從可選到強制的轉(zhuǎn)型。這一進程在2018年擴展至臨床試驗申請(IND),,終實現(xiàn)全類型藥品注冊的電子化覆蓋杭州原料藥eCTD遞交
- 高新區(qū)中國eCTD歡迎選購 2025-05-14
- 靜安區(qū)生物制品eCTD使用 2025-05-14
- 蕪湖新藥eCTD是什么 2025-05-14
- 吳江區(qū)賦悅科技eCTD供應(yīng)商 2025-05-14
- 南京生物制品eCTD注冊系統(tǒng) 2025-05-14
- 上?;瘜W(xué)藥品eCTD格式 2025-05-09
- 南京電子申報eCTD哪個品牌好 2025-05-09
- 太倉NDAeCTD服務(wù)價格 2025-05-09
- 浦東新區(qū)原料藥eCTD文件如何制作 2025-04-26
- 南京新藥eCTD找哪家 2025-04-26
- 諸暨墨倉式復(fù)印機租賃市場價 2025-06-04
- 零配件系統(tǒng)哪些好用 2025-06-04
- 貴州多網(wǎng)口華碩工控機規(guī)格齊全 2025-06-04
- 福建BEl傳感器BEIGHM406-1024-036 2025-06-04
- 北京BEIIDEACOD編碼器BEIDHM510-1024-003 2025-06-04
- 蘇州美標(biāo)充電槍測試儀器找誰買 2025-06-04
- 中鑫超頻服務(wù)器 2025-06-04
- 越城區(qū)國產(chǎn)復(fù)印機租賃聯(lián)系方式 2025-06-04
- 淮安好的氨綸高新技術(shù)化纖現(xiàn)貨 2025-06-04
- 科爾沁區(qū)進口推廣生產(chǎn)企業(yè) 2025-06-04