靜安區(qū)中國eCTD供應(yīng)商
PDF工具箱 ?批量處理與格式修復 支持PDF合并,、拆分,、提取頁面、旋轉(zhuǎn)頁面等操作,,可批量修復字體未嵌入,、超鏈接錯誤等問題,確保文件符合藥品注冊法規(guī)要求,。 ?智能書簽與超鏈接管理 提供書簽導入/導出,、超鏈接自動生成(支持關(guān)鍵字搜索定位鏈接)、題注超鏈接拖拽式編輯等功能,,簡化復雜文檔的導航設(shè)計,。 ?文檔轉(zhuǎn)換與OCR識別 支持Word轉(zhuǎn)PDF(自動生成書簽、嵌入字體),,以及PDF與Word,、Excel等格式互轉(zhuǎn),集成OCR功能用于掃描件文字識別,。 ?合規(guī)性驗證 自動驗證PDF的頁面布局,、頁碼連續(xù)性、空白頁,、目錄層級等屬性,,并定位具體錯誤位置,減少人工檢查成本,。 ?安全與協(xié)作功能 支持文檔加密,、數(shù)字簽名、云端同步及多設(shè)備共享,,滿足企業(yè)級文件安全管理需求,。中NDA注冊申報相關(guān)技術(shù)支持。靜安區(qū)中國eCTD供應(yīng)商

爭議解決與法律救濟 若申請人對審評結(jié)果有異議,,可向EMA的CHMP申請重審查,,或在歐盟法院提起行政訴訟。eCTD的完整提交記錄可作為法律證據(jù),,證明申請人已履行合規(guī)義務(wù)。EDQM設(shè)立仲裁委員會,,處理CEP程序中的技術(shù)爭議,。 行業(yè)趨勢與競爭格局 全球eCTD服務(wù)市場年增長率達12%,歐盟占據(jù)35%份額,,主要服務(wù)商包括PharmaLex,、Certara等。頭部藥企通過自建IT團隊降低成本,,而中小型企業(yè)依賴外包以專注研發(fā),。人工智能(AI)在文件自動生成和審評意見預測中的應(yīng)用逐漸增多,。 患者參與與透明度提升 EMA通過公開eCTD摘要(如模塊2.5臨床概要)增強審評透明度,患者組織可提交意見影響審評決策,。部分成員國要求模塊1包含患者語言版本說明書,,以提升用藥依從性。未來,,eCTD4.0或支持直接鏈接患者反饋平臺,,實現(xiàn)全生命周期互動。楊浦區(qū)原料藥eCTD發(fā)布軟件加拿大IND注冊申報相關(guān)技術(shù)支持,。
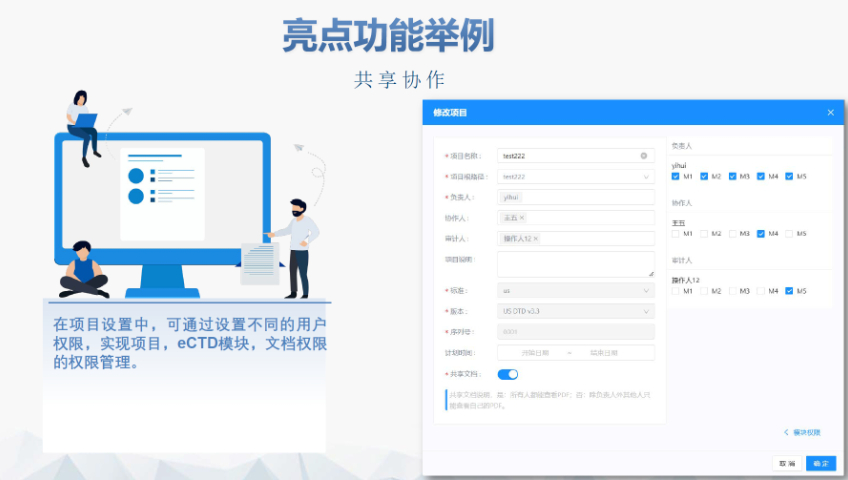
DMF維護與合規(guī) ?年度更 即使無變更,,每年需提交聲明;重大工藝/設(shè)施變更需及時通知客戶并更文件,。 ?現(xiàn)場檢查 原料藥企業(yè)需通過FDA現(xiàn)場檢查,,驗證是否符合ICH Q7 GMP標準,并與DMF內(nèi)容一致,。 ?轉(zhuǎn)讓與關(guān)閉 ?轉(zhuǎn)讓:需書面通知FDA并提供持有者信息,。 ?關(guān)閉:未提交年度報告或持有人主動申請,需說明原因并通知所有授權(quán)方,。 關(guān)鍵注意事項 ?數(shù)據(jù)質(zhì)量:所有資料需準確,、完整,減少審核延遲風險,。 ?合規(guī)性:遵循FDA指南(如21 CFR Part 207)及USP標準(如培養(yǎng)基物料來源級別),。 ?溝通機制:建議通過專業(yè)機構(gòu)(如瑞歐佰藥)協(xié)助,定期提交周報并制定計劃表以提高效率,。 常見問題解答 ?生物制品分類:培養(yǎng)基,、外泌體等均屬Ⅱ類DMF。 ?質(zhì)量標準:參考USP及同行標準,,需提供分析方法驗證及雜質(zhì)對比研究,。 ?周期估算:資料準備約5-50個工作日,總周期受缺陷回復影響,。
2015年發(fā)布《關(guān)于藥品醫(yī)療器械審評審批制度的意見》,,提出藥監(jiān)五大目標,將eCTD納入國家藥監(jiān)數(shù)字化戰(zhàn)略,。2017年,,中國加入ICH(國際人用藥品注冊技術(shù)協(xié)調(diào)會),成為全球第八個監(jiān)管機構(gòu)成員,,加速與國際標準接軌,。2018年,國家藥監(jiān)局(NMPA)完成eCTD文檔管理系統(tǒng)招標,由上海寶信與德國LORENZ合作搭建技術(shù)平臺,,標志著技術(shù)基礎(chǔ)設(shè)施的落地,。 ?規(guī)范制定與試點階段(2019-2023年)? 2019-2020年,CDE(藥品審評中心)發(fā)布《eCTD技術(shù)規(guī)范》《驗證標準》等征求意見稿,,并組織兩輪企業(yè)測試,。2021年,NMPA明確化學藥1類,、5.1類及生物制品1類上市申請適用eCTD,。2022年實施電子申報(非eCTD格式),2023年取消紙質(zhì)資料提交,,為eCTD鋪開奠定基礎(chǔ),。 ?實施與擴展階段(2024-2025年)? 2024年3月更電子申報技術(shù)要求,7月啟動網(wǎng)絡(luò)傳輸試點,。2025年1月27日,,NMPA將eCTD適用范圍擴大至化藥1-5類臨床試驗及上市申請、生物制品1-3類全流程,,覆蓋藥,、仿制藥及生物類似藥,實現(xiàn)與國際主流申報模式同步,。eCTD驗證實踐手冊相關(guān)技術(shù)支持,。
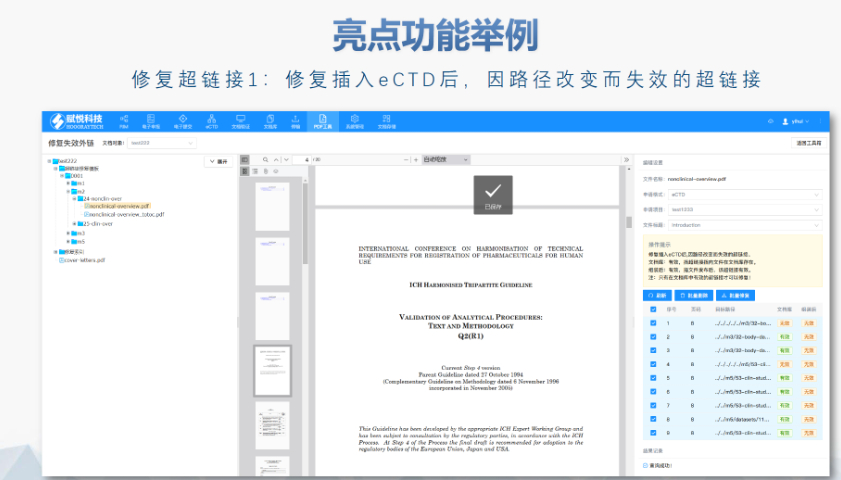
中國將進一步與國際接軌,推進eCTD等標準應(yīng)用,,提高藥品注冊效率和質(zhì)量,。AI技術(shù)可能在藥品注冊領(lǐng)域廣泛應(yīng)用,如輔助審評人員工作,。未來藥品注冊資料將更注重結(jié)構(gòu)化數(shù)據(jù),,有助于監(jiān)管機構(gòu)高效獲取和利用數(shù)據(jù)。 eCTD等數(shù)字化工具將推動藥品監(jiān)管向智慧監(jiān)管和全生命周期監(jiān)管發(fā)展,,提高監(jiān)管效率和質(zhì)量,。區(qū)塊鏈技術(shù)具有應(yīng)用前景,可構(gòu)建全球統(tǒng)一的藥品申報數(shù)據(jù)平臺,。數(shù)據(jù)化時代,,藥品注冊領(lǐng)域?qū)⒏⒅財?shù)據(jù)收集、分析和利用,,為監(jiān)管機構(gòu)和企業(yè)提供決策支持,。 總而言之,展望未來,,隨著eCTD在藥品注冊領(lǐng)域的廣泛應(yīng)用和不斷發(fā)展,中國將逐步建立起與國際接軌的藥品注冊體系,。這將有助于提高中國藥品注冊的效率和質(zhì)量,,推動中國藥品走向世界舞臺,。同時,企業(yè)也需要密切關(guān)注技術(shù)發(fā)展動態(tài)和監(jiān)管政策變化,,及時調(diào)整自身戰(zhàn)略和規(guī)劃,,以適應(yīng)未來的市場競爭和監(jiān)管要求。瑞士eCTD驗證標準相關(guān)技術(shù)支持,。中國香港eCTD哪個品牌好
澳大利亞eCTD申報軟件相關(guān)技術(shù)支持,。靜安區(qū)中國eCTD供應(yīng)商
eCTD生命周期管理與變更提交:歐盟要求eCTD申報資料覆蓋藥品全生命周期,包括提交,、補充申請及實質(zhì)性變更,。例如,增成員國需提交“附加成員國序列”,,審評時間約52-83天,;重大變更(如生產(chǎn)工藝調(diào)整)需創(chuàng)建序列并通過CTIS平臺更模塊3和模塊1的GMP證明。技術(shù)驗證工具(如EDQM推薦的檢查軟件)需在每次提交前運行,,確保XML骨架文件與PDF書簽層級符合規(guī)范,。此外,電子簽章需符合《歐盟電子簽名法》,,并在模塊1中明確標注法律效力,。歐洲通用提交門戶(Common European Submission Portal,CESP)是歐盟及成員國藥品監(jiān)管機構(gòu)間用于電子化提交申報資料的重要平臺,。以下是關(guān)于CESP的詳細介紹: CESP是由歐盟藥品監(jiān)管部門負責人網(wǎng)絡(luò)(HMA)合作開發(fā)的在線交付系統(tǒng),,旨在為藥品注冊申請者、利益相關(guān)方和監(jiān)管機構(gòu)之間提供統(tǒng)一,、安全的電子提交通道,。其設(shè)計初衷是簡化跨國申報流程,允許通過單一門戶向多個歐洲國家的藥監(jiān)部門同時提交申請,,避免了重復操作,。靜安區(qū)中國eCTD供應(yīng)商
- 高新區(qū)中國eCTD歡迎選購 2025-05-14
- 靜安區(qū)生物制品eCTD使用 2025-05-14
- 蕪湖新藥eCTD是什么 2025-05-14
- 吳江區(qū)賦悅科技eCTD供應(yīng)商 2025-05-14
- 南京生物制品eCTD注冊系統(tǒng) 2025-05-14
- 上海化學藥品eCTD格式 2025-05-09
- 南京電子申報eCTD哪個品牌好 2025-05-09
- 太倉NDAeCTD服務(wù)價格 2025-05-09
- 浦東新區(qū)原料藥eCTD文件如何制作 2025-04-26
- 南京新藥eCTD找哪家 2025-04-26
- 機械CT掃描儀注意事項 2025-06-19
- 江蘇噴墨打印機辦公設(shè)備租賃耗材全包 2025-06-19
- 自動同城引流技術(shù)參數(shù) 2025-06-19
- 東莞自動化網(wǎng)絡(luò)維護型號 2025-06-19
- 西南離散行業(yè)軟件商品牌 2025-06-19
- 天津電動汽車充電槍測試儀器報價 2025-06-19
- 深圳2U服務(wù)器機箱廠商訂制 2025-06-19
- 企業(yè)數(shù)字化轉(zhuǎn)型包括那些方面 2025-06-19
- 河南蜂蜜哪里有賣的 2025-06-19
- 天津自動化在線式翹曲檢測 2025-06-19