浦東新區(qū)仿制藥eCTD性價比
eCTD的法規(guī)框架與技術規(guī)范:歐盟eCTD的法規(guī)層級包括指南(Guidelines)、指令(Directive)和法規(guī)(Regulation),。其中,法規(guī)(如CTR)具有直接法律效力,,而指南(如ICH eCTD規(guī)范)則為技術操作提供參考。eCTD的結構需符合歐盟模塊1規(guī)范(DTD 3.0+),,包含行政文件(模塊1),、質量數據(模塊3)及臨床研究報告(模塊5)等內容,并通過XML文件實現數據互聯(lián),。例如,,CEP(歐洲藥典適用性證書)的eCTD申報需單獨構建信封(Envelope)和模塊1,并指定標識符(UUID)以確保技術合規(guī)性,。瑞士eCTD注冊外包相關技術支持,。浦東新區(qū)仿制藥eCTD性價比
審評效率與時間線優(yōu)化 eCTD的標準化縮短了審評周期:集中程序平均審評時間從18個月降至12個月,互認程序可在90天內完成成員國意見協(xié)調,。自動化驗證工具減少了格式錯誤導致的退審率,但復雜藥學數據的科學審評仍需較長時間,。申請人可通過預提交會議(Pre-submission meeting)提前溝通技術細節(jié),,規(guī)避潛在延誤。 區(qū)域協(xié)作與全球互認 歐盟通過互認程序與澳大利亞,、加拿大等國實現eCTD數據共享,,CEP證書在40余個非歐盟國家有效。然而,,模塊一區(qū)域信息的差異性仍要求申請人定制化調整,,例如亞洲國家可能要求附加穩(wěn)定性研究數據。ICH的協(xié)調作用有助于減少重復提交,,但完全全球化仍需解決法規(guī)和技術壁壘,。 技術工具與行業(yè)生態(tài) 主流eCTD編輯軟件(如Lorenz、Extedo)支持歐盟區(qū)域模板的自動化生成,,并與驗證工具集成實現一鍵校驗,。云平臺解決方案逐漸普及,支持多國團隊協(xié)同編輯和實時版本控制,。然而,,軟件采購和維護成本較高,中小企業(yè)常選擇外包給專業(yè)服務商完成遞交。寧波賦悅科技eCTD系統(tǒng)瑞士eCTD申報軟件相關技術支持,。
eCTD生命周期管理與變更提交:歐盟要求eCTD申報資料覆蓋藥品全生命周期,,包括提交、補充申請及實質性變更,。例如,,增成員國需提交“附加成員國序列”,審評時間約52-83天,;重大變更(如生產工藝調整)需創(chuàng)建序列并通過CTIS平臺更模塊3和模塊1的GMP證明,。技術驗證工具(如EDQM推薦的檢查軟件)需在每次提交前運行,確保XML骨架文件與PDF書簽層級符合規(guī)范,。此外,,電子簽章需符合《歐盟電子簽名法》,并在模塊1中明確標注法律效力,。歐洲通用提交門戶(Common European Submission Portal,,CESP)是歐盟及成員國藥品監(jiān)管機構間用于電子化提交申報資料的重要平臺。以下是關于CESP的詳細介紹: CESP是由歐盟藥品監(jiān)管部門負責人網絡(HMA)合作開發(fā)的在線交付系統(tǒng),,旨在為藥品注冊申請者,、利益相關方和監(jiān)管機構之間提供統(tǒng)一、安全的電子提交通道,。其設計初衷是簡化跨國申報流程,,允許通過單一門戶向多個歐洲國家的藥監(jiān)部門同時提交申請,避免了重復操作,。
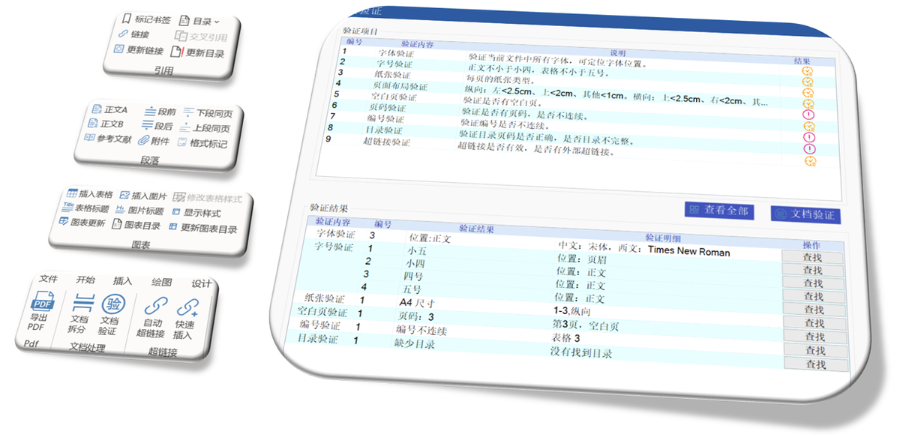
賦悅Word插件 自主研發(fā)Word插件 快速編輯:整合word常用功能按鈕,,避免頻繁切換菜單;內置標題,、段落,、文字、目錄,、超鏈接等的格式和樣式,,可快速設置和更文檔的格式 快速鏈接:雙擊或者拖拽的方式,制作文本超鏈接或者題注超鏈接,;可搜索全文關鍵字,,自動制作超鏈接 文檔拆分:可根據不同的條件將word文件顆粒化,,如分節(jié)符,、頁眉、頁腳,、頁碼范圍和自定義頁碼等 PDF轉換:WORD轉PDF,,自動判斷是否生成書簽,,自動鑲嵌所有字體,生成PDF快速網頁瀏覽的PDF,,確保生成的PDF所有屬性符合法規(guī)要求 文檔驗證:驗證文檔的字體,、字號、紙張,、頁面布局,、空白頁、頁碼,、編號,、目錄、超鏈接等,,并且可以定位驗證結果 可定制:可根據用戶需求定制格式和樣式模板美國eCTD注冊咨詢相關技術支持,。

區(qū)域化差異與多國協(xié)作挑戰(zhàn) 歐盟eCTD需兼容成員國特定要求,例如模塊一的行政信息需符合各國語言和法規(guī)差異,?;フJ程序(MRP)中,參考成員國(RMS)的評估報告需被其他成員國認可,,若出現分歧需由CMDh協(xié)調或提交EMA仲裁,。這種多層級審評機制要求申請人在文件準備階段即考慮區(qū)域兼容性,避免后續(xù)流程延誤,。 eCTD4.0的探索與未來方向 ICH于2015年發(fā)布的eCTD4.0版本旨在簡化目錄結構,、支持多產品類型(如醫(yī)療器械)申報,并增強生命周期管理功能,。歐盟計劃通過2024年試點逐步過渡至4.0,,其扁平化文件組織方式有望減少重復提交并提升審評效率。然而,,實施需解決現有系統(tǒng)兼容性及行業(yè)適應性問題。加拿大DMF注冊申報關技術支持,。青海國產eCTD
美國ESG電子提交通道申請相關技術支持,。浦東新區(qū)仿制藥eCTD性價比
2015年發(fā)布《關于藥品醫(yī)療器械審評審批制度的意見》,提出藥監(jiān)五大目標,,將eCTD納入國家藥監(jiān)數字化戰(zhàn)略,。2017年,中國加入ICH(國際人用藥品注冊技術協(xié)調會),,成為全球第八個監(jiān)管機構成員,,加速與國際標準接軌。2018年,,國家藥監(jiān)局(NMPA)完成eCTD文檔管理系統(tǒng)招標,,由上海寶信與德國LORENZ合作搭建技術平臺,,標志著技術基礎設施的落地。 ?規(guī)范制定與試點階段(2019-2023年)? 2019-2020年,,CDE(藥品審評中心)發(fā)布《eCTD技術規(guī)范》《驗證標準》等征求意見稿,,并組織兩輪企業(yè)測試。2021年,,NMPA明確化學藥1類,、5.1類及生物制品1類上市申請適用eCTD。2022年實施電子申報(非eCTD格式),,2023年取消紙質資料提交,,為eCTD鋪開奠定基礎。 ?實施與擴展階段(2024-2025年)? 2024年3月更電子申報技術要求,,7月啟動網絡傳輸試點,。2025年1月27日,NMPA將eCTD適用范圍擴大至化藥1-5類臨床試驗及上市申請,、生物制品1-3類全流程,,覆蓋藥、仿制藥及生物類似藥,,實現與國際主流申報模式同步,。浦東新區(qū)仿制藥eCTD性價比
- 高新區(qū)中國eCTD歡迎選購 2025-05-14
- 靜安區(qū)生物制品eCTD使用 2025-05-14
- 蕪湖新藥eCTD是什么 2025-05-14
- 吳江區(qū)賦悅科技eCTD供應商 2025-05-14
- 南京生物制品eCTD注冊系統(tǒng) 2025-05-14
- 上海化學藥品eCTD格式 2025-05-09
- 南京電子申報eCTD哪個品牌好 2025-05-09
- 太倉NDAeCTD服務價格 2025-05-09
- 浦東新區(qū)原料藥eCTD文件如何制作 2025-04-26
- 南京新藥eCTD找哪家 2025-04-26
- 標準工作站費用 2025-06-09
- 上海視頻話機硬件廠家 2025-06-09
- 蘇州信息機房環(huán)境監(jiān)控系統(tǒng) 2025-06-09
- 順義區(qū)不銹鋼機箱加工 2025-06-09
- 常州智能化自動化控制系統(tǒng)參考價 2025-06-09
- 清遠檔案自動化修圖軟件售價 2025-06-09
- 南昌3D虛擬人服務商 2025-06-09
- 廣東子母鐘服務器 2025-06-09
- 重慶本地蜂蜜 2025-06-09
- 福建品牌軟件開發(fā) 2025-06-09