-
掘進(jìn)機(jī)常見(jiàn)故障分析及處理方法
-
懸臂式掘進(jìn)機(jī)與全斷面掘進(jìn)機(jī)的區(qū)別
-
正確使用采煤機(jī)截齒及其重要性
-
掘進(jìn)機(jī)截齒:礦山開(kāi)采的鋒銳利器
-
掘進(jìn)機(jī)的多樣類型與廣闊市場(chǎng)前景
-
怎么樣對(duì)掘進(jìn)機(jī)截割減速機(jī)進(jìn)行潤(rùn)滑呢?
-
哪些因素會(huì)影響懸臂式掘進(jìn)機(jī)配件的性能,?
-
懸臂式掘進(jìn)機(jī)常見(jiàn)型號(hào)
-
懸臂式掘進(jìn)機(jī)的相關(guān)介紹及發(fā)展現(xiàn)狀
-
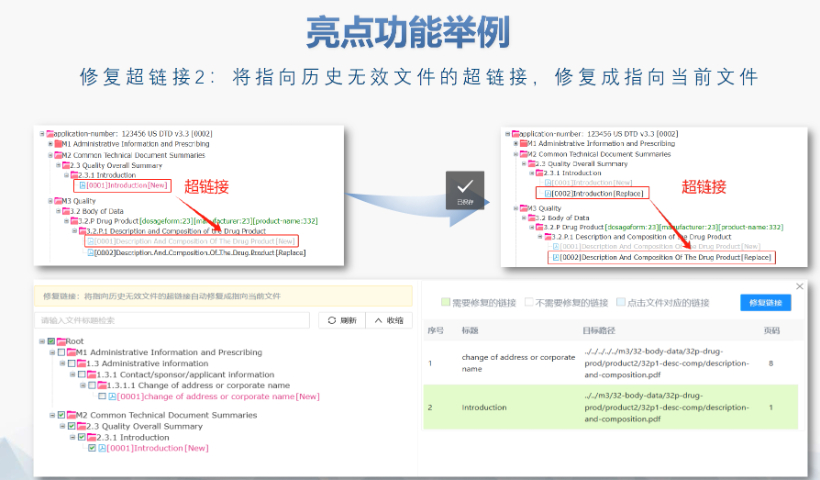
掘錨機(jī)配件的檢修及維護(hù)
江蘇NDAeCTD服務(wù)放心可靠
FDA圍繞eCTD發(fā)布了10余項(xiàng)法規(guī)指南,涵蓋格式要求,、文件生命周期,、數(shù)據(jù)安全等細(xì)節(jié),其中《ICH M2 EWG》作為綜合性技術(shù)文件,,成為企業(yè)申報(bào)的參考,。eCTD的實(shí)施提升了審評(píng)效率,通過(guò)標(biāo)準(zhǔn)化XML結(jié)構(gòu)和電子簽章技術(shù),,減少了紙質(zhì)遞交的物流與時(shí)間成本,,同時(shí)支持全生命周期管理,便于后續(xù)變更和補(bǔ)充資料的動(dòng)態(tài)更,。 美國(guó)在eCTD實(shí)施中注重與ICH國(guó)際標(biāo)準(zhǔn)的兼容性,,例如采用統(tǒng)一的CTD模塊化結(jié)構(gòu)和PDF技術(shù)規(guī)范,。然而,其區(qū)域性要求(如信封信息中的Application ID,、Submission Subtype)仍體現(xiàn)本土化特色,。這種“國(guó)際框架+本地適配”的模式,既保障了跨國(guó)藥企的申報(bào)便利,,又滿足了FDA的監(jiān)管需求,。美國(guó)ANDA注冊(cè)申報(bào)相關(guān)技術(shù)支持。江蘇NDAeCTD服務(wù)放心可靠
2020年暴發(fā)后,,F(xiàn)DA進(jìn)一步推動(dòng)電子化進(jìn)程,,例如允許遠(yuǎn)程電子簽章和臨時(shí)放寬部分格式要求,但驗(yàn)證標(biāo)準(zhǔn)(如PDF版本,、書(shū)簽鏈接有效性)并未降低,。這一時(shí)期的實(shí)踐為eCTD在緊急審批中的靈活性提供了案例,也凸顯了其作為危機(jī)應(yīng)對(duì)工具的價(jià)值,。 盡管美國(guó)尚未部署eCTD V4.0,,但其技術(shù)方向已明確:支持醫(yī)療器械和保健品申報(bào)、增強(qiáng)數(shù)據(jù)可復(fù)用性,、優(yōu)化審評(píng)系統(tǒng)與人工智能的集成,。此外,區(qū)塊鏈技術(shù)在電子簽章和數(shù)據(jù)溯源中的應(yīng)用探索,,可能成為下一階段升級(jí)的重點(diǎn)江蘇NDAeCTD服務(wù)放心可靠歐盟eCTD申報(bào)軟件相關(guān)技術(shù)支持,。
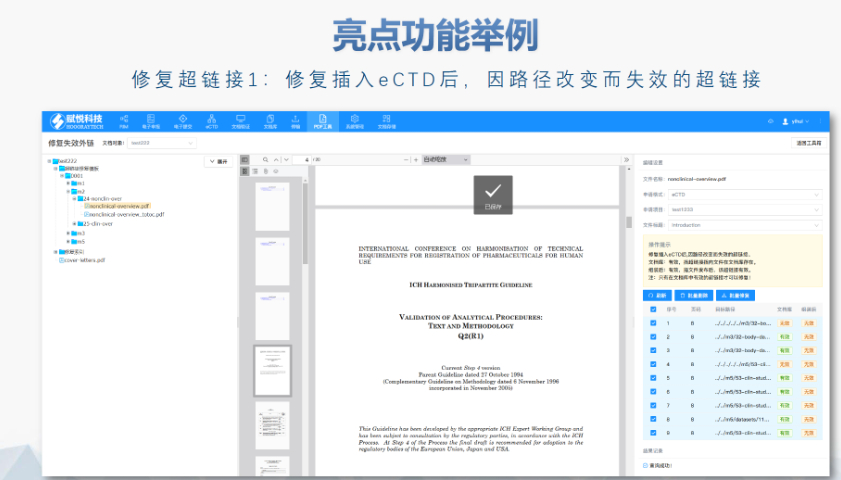
歐洲藥品管理局:集中審評(píng)程序由歐洲藥品管理局(European Medicines Agency, EMA)負(fù)責(zé)協(xié)調(diào)。 人用藥品委員會(huì):人用藥品委員會(huì)(Committee for Medicinal Products for Human Use, CHMP)負(fù)責(zé)提供科學(xué)意見(jiàn),。 歐盟委員會(huì):CHMP的意見(jiàn)隨后被提交給歐盟委員會(huì)(European Commission, EC),,由歐盟委員會(huì)做出是否授權(quán)的終決定。這個(gè)決定在整個(gè)歐盟都是具有法律約束力的,。 審批過(guò)程: 申請(qǐng)人向EMA提交申請(qǐng),,包括eCTD(電子通用技術(shù)文檔)格式的藥品注冊(cè)文檔。 EMA的CHMP分配一個(gè)科學(xué)評(píng)估團(tuán)隊(duì)(Rapporteur和Co-Rapporteur),,負(fù)責(zé)初步評(píng)估,。 CHMP基于評(píng)估團(tuán)隊(duì)的報(bào)告提供科學(xué)意見(jiàn)。 歐盟委員會(huì)根據(jù)CHMP的意見(jiàn)做出終決定,,批準(zhǔn)或拒絕藥品上市,。 授權(quán)范圍 如果藥品獲得批準(zhǔn),將獲得在整個(gè)歐盟,、冰島,、列支敦士登和挪威有效的上市許可(Central Marketing Authorisation, CMA)。
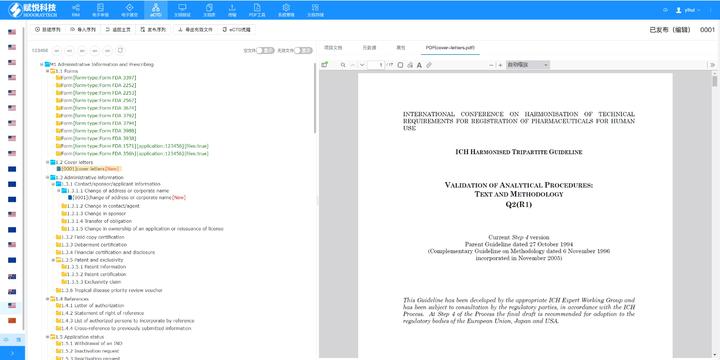
PDF工具箱 ?批量處理與格式修復(fù) 支持PDF合并,、拆分,、提取頁(yè)面,、旋轉(zhuǎn)頁(yè)面等操作,可批量修復(fù)字體未嵌入,、超鏈接錯(cuò)誤等問(wèn)題,,確保文件符合藥品注冊(cè)法規(guī)要求。 ?智能書(shū)簽與超鏈接管理 提供書(shū)簽導(dǎo)入/導(dǎo)出,、超鏈接自動(dòng)生成(支持關(guān)鍵字搜索定位鏈接),、題注超鏈接拖拽式編輯等功能,簡(jiǎn)化復(fù)雜文檔的導(dǎo)航設(shè)計(jì),。 ?文檔轉(zhuǎn)換與OCR識(shí)別 支持Word轉(zhuǎn)PDF(自動(dòng)生成書(shū)簽,、嵌入字體),以及PDF與Word,、Excel等格式互轉(zhuǎn),,集成OCR功能用于掃描件文字識(shí)別,。 ?合規(guī)性驗(yàn)證 自動(dòng)驗(yàn)證PDF的頁(yè)面布局,、頁(yè)碼連續(xù)性、空白頁(yè),、目錄層級(jí)等屬性,,并定位具體錯(cuò)誤位置,減少人工檢查成本,。 ?安全與協(xié)作功能 支持文檔加密,、數(shù)字簽名、云端同步及多設(shè)備共享,,滿足企業(yè)級(jí)文件安全管理需求,。加拿大eCTD申報(bào)軟件相關(guān)技術(shù)支持。
美國(guó)藥物主文件(Drug Master File, DMF)是向FDA提交的機(jī)密技術(shù)文件,,用于支持藥品生產(chǎn),、質(zhì)量控制及合規(guī)性審查。以下為申報(bào)的要點(diǎn)和流程總結(jié): DMF概述與類型 ?定義與作用 DMF是藥品生產(chǎn)全過(guò)程的詳細(xì)檔案,,包含原料藥,、輔料、包裝材料等的生產(chǎn)設(shè)施,、工藝,、質(zhì)量控制等信息,供制劑廠商引用以支持其注冊(cè)申請(qǐng),。其意義在于保護(hù)企業(yè)機(jī)密的同時(shí),,滿足FDA對(duì)供應(yīng)鏈透明度的要求。 ?DMF類型 ?Ⅱ類:原料藥,、中間體及制劑(如微生物外泌體,、細(xì)胞株等生物制品均屬此類),。 ?Ⅲ類:包裝材料。 ?Ⅳ類:輔料,、著色劑等添加劑,。 ?Ⅴ類:非臨床/臨床數(shù)據(jù)等特殊信息(需FDA預(yù)先批準(zhǔn))。 注:Ⅰ型(生產(chǎn)設(shè)施與人員)已于2000年停用,。瑞士eCTD注冊(cè)申報(bào)相關(guān)技術(shù)支持,。靜安區(qū)原料藥eCTD銷(xiāo)售電話
瑞士IND注冊(cè)申報(bào)相關(guān)技術(shù)支持。江蘇NDAeCTD服務(wù)放心可靠
中國(guó)將進(jìn)一步與國(guó)際接軌,,推進(jìn)eCTD等標(biāo)準(zhǔn)應(yīng)用,,提高藥品注冊(cè)效率和質(zhì)量。AI技術(shù)可能在藥品注冊(cè)領(lǐng)域廣泛應(yīng)用,,如輔助審評(píng)人員工作,。未來(lái)藥品注冊(cè)資料將更注重結(jié)構(gòu)化數(shù)據(jù),有助于監(jiān)管機(jī)構(gòu)高效獲取和利用數(shù)據(jù),。 eCTD等數(shù)字化工具將推動(dòng)藥品監(jiān)管向智慧監(jiān)管和全生命周期監(jiān)管發(fā)展,,提高監(jiān)管效率和質(zhì)量。區(qū)塊鏈技術(shù)具有應(yīng)用前景,,可構(gòu)建全球統(tǒng)一的藥品申報(bào)數(shù)據(jù)平臺(tái),。數(shù)據(jù)化時(shí)代,藥品注冊(cè)領(lǐng)域?qū)⒏⒅財(cái)?shù)據(jù)收集,、分析和利用,,為監(jiān)管機(jī)構(gòu)和企業(yè)提供決策支持。 總而言之,,展望未來(lái),,隨著eCTD在藥品注冊(cè)領(lǐng)域的廣泛應(yīng)用和不斷發(fā)展,中國(guó)將逐步建立起與國(guó)際接軌的藥品注冊(cè)體系,。這將有助于提高中國(guó)藥品注冊(cè)的效率和質(zhì)量,,推動(dòng)中國(guó)藥品走向世界舞臺(tái)。同時(shí),,企業(yè)也需要密切關(guān)注技術(shù)發(fā)展動(dòng)態(tài)和監(jiān)管政策變化,,及時(shí)調(diào)整自身戰(zhàn)略和規(guī)劃,以適應(yīng)未來(lái)的市場(chǎng)競(jìng)爭(zhēng)和監(jiān)管要求,。江蘇NDAeCTD服務(wù)放心可靠
- 高新區(qū)中國(guó)eCTD歡迎選購(gòu) 2025-05-14
- 靜安區(qū)生物制品eCTD使用 2025-05-14
- 蕪湖新藥eCTD是什么 2025-05-14
- 吳江區(qū)賦悅科技eCTD供應(yīng)商 2025-05-14
- 南京生物制品eCTD注冊(cè)系統(tǒng) 2025-05-14
- 上?;瘜W(xué)藥品eCTD格式 2025-05-09
- 南京電子申報(bào)eCTD哪個(gè)品牌好 2025-05-09
- 太倉(cāng)NDAeCTD服務(wù)價(jià)格 2025-05-09
- 浦東新區(qū)原料藥eCTD文件如何制作 2025-04-26
- 南京新藥eCTD找哪家 2025-04-26
- 上海智能戒指推薦 2025-06-15
- 河南原裝華碩工控機(jī)銷(xiāo)售公司 2025-06-15
- 雙鴨山什么是自媒體營(yíng)銷(xiāo)推廣 2025-06-15
- 天津醫(yī)療攝像頭模組廠商 2025-06-15
- 南京進(jìn)口辦公自動(dòng)化系統(tǒng)均價(jià) 2025-06-15
- 上海數(shù)字檔案管理系統(tǒng)廠家推薦 2025-06-15
- 宜興購(gòu)買(mǎi)光解膜廠家直銷(xiāo) 2025-06-15
- 建鄴區(qū)企業(yè)管理服務(wù)圖片 2025-06-15
- 內(nèi)蒙古發(fā)展推廣技術(shù)參數(shù) 2025-06-15
- 徐州互聯(lián)網(wǎng)數(shù)據(jù)服務(wù)共同合作 2025-06-15