天津eCTD文件如何制作
設(shè)施費(fèi)動(dòng)態(tài)調(diào)整 API工廠和制劑工廠年費(fèi)分別約6.8萬和14.5萬美元(2025財(cái)年),,CMO工廠費(fèi)用為制劑費(fèi)的24%,。國(guó)外工廠需額外支付1.5萬美元跨境檢查費(fèi)。 ?繳費(fèi)時(shí)限與懲罰 費(fèi)用需在財(cái)年首日(10月1日)起20天內(nèi)繳納,,逾期將列入拖欠名單并暫停ANDA受理,,涉事藥品視為冒牌產(chǎn)品。 ?豁免與特殊情形 PET藥物,、非商業(yè)產(chǎn)品及停產(chǎn)超一年的工廠可豁免繳費(fèi),。已繳費(fèi)工廠若年度內(nèi)無生產(chǎn)活動(dòng),仍需繳納費(fèi)用,。 ?行業(yè)影響與策略 費(fèi)用上漲推動(dòng)企業(yè)優(yōu)化申報(bào)策略,,例如集中ANDA提交周期、采用CMO外包降低設(shè)施費(fèi),,并通過預(yù)認(rèn)證(如DMF完整性評(píng)估)減少重復(fù)支出,。 歐盟DMF注冊(cè)申報(bào)相關(guān)技術(shù)支持。天津eCTD文件如何制作
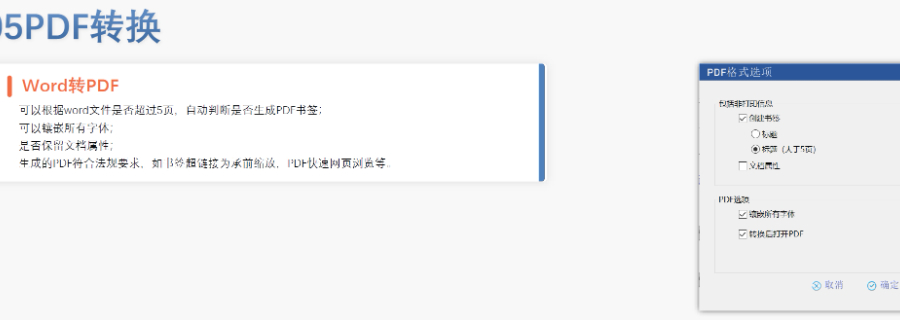
eCTD的實(shí)施為監(jiān)管機(jī)構(gòu)和企業(yè)帶來了多重機(jī)遇,。電子化申報(bào)資料能夠極大地加速審評(píng)效率,,減少人為判斷錯(cuò)誤和數(shù)據(jù)混淆的情況,,從而提高審評(píng)的準(zhǔn)確性和速度。同時(shí),,eCTD帶來的數(shù)據(jù)標(biāo)準(zhǔn)化機(jī)遇使得全球監(jiān)管機(jī)構(gòu)的資料內(nèi)容和電子格式得以統(tǒng)一,,有助于在不同監(jiān)管機(jī)構(gòu)之間進(jìn)行數(shù)據(jù)傳輸和共享。這對(duì)于提升全球監(jiān)管效率和行業(yè)研發(fā)效率具有重要意義,。 此外,,eCTD的實(shí)施還促進(jìn)了國(guó)際合作,構(gòu)建了全球監(jiān)管的底層大數(shù)據(jù)基礎(chǔ),。對(duì)于企業(yè)而言,,eCTD提供了一個(gè)規(guī)范化的研發(fā)活動(dòng)模板,有助于降低與監(jiān)管機(jī)構(gòu)溝通的成本,,提高申報(bào)效率,。特別是對(duì)于國(guó)內(nèi)的生物技術(shù)企業(yè)而言,eCTD的實(shí)施更是具有重要意義,,有助于這些企業(yè)更好地走向國(guó)際市場(chǎng),。然而,中小企業(yè)在享受這些機(jī)遇的同時(shí),,也面臨著技術(shù)和成本壓力,。eCTD的實(shí)施需要專門的團(tuán)隊(duì)進(jìn)行系統(tǒng)維護(hù)和開發(fā),這對(duì)于中小企業(yè)來說是一筆不小的開支,。同時(shí),數(shù)據(jù)安全問題也是企業(yè)關(guān)注的焦點(diǎn),。 此次CDE擴(kuò)大eCTD實(shí)施范圍對(duì)行業(yè)而言是一個(gè)積極的風(fēng)向標(biāo),。短期內(nèi),企業(yè)面臨的挑戰(zhàn)包括適應(yīng)更高要求的技術(shù)規(guī)范并提高文件質(zhì)量,、和eCTD出版系統(tǒng)的磨合以及進(jìn)行eCTD知識(shí)的跨職能培訓(xùn)等,。 上海國(guó)內(nèi)注冊(cè)eCTD系統(tǒng)加拿大NDA注冊(cè)申報(bào)相關(guān)技術(shù)支持。
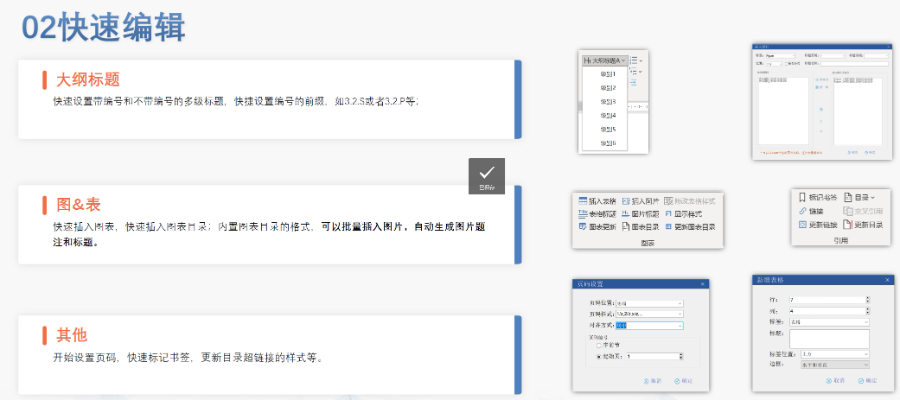
區(qū)域化差異與多國(guó)協(xié)作挑戰(zhàn) 歐盟eCTD需兼容成員國(guó)特定要求,,例如模塊一的行政信息需符合各國(guó)語言和法規(guī)差異,。互認(rèn)程序(MRP)中,,參考成員國(guó)(RMS)的評(píng)估報(bào)告需被其他成員國(guó)認(rèn)可,,若出現(xiàn)分歧需由CMDh協(xié)調(diào)或提交EMA仲裁。這種多層級(jí)審評(píng)機(jī)制要求申請(qǐng)人在文件準(zhǔn)備階段即考慮區(qū)域兼容性,,避免后續(xù)流程延誤,。 eCTD4.0的探索與未來方向 ICH于2015年發(fā)布的eCTD4.0版本旨在簡(jiǎn)化目錄結(jié)構(gòu)、支持多產(chǎn)品類型(如醫(yī)療器械)申報(bào),,并增強(qiáng)生命周期管理功能,。歐盟計(jì)劃通過2024年試點(diǎn)逐步過渡至4.0,,其扁平化文件組織方式有望減少重復(fù)提交并提升審評(píng)效率。然而,,實(shí)施需解決現(xiàn)有系統(tǒng)兼容性及行業(yè)適應(yīng)性問題,。
危機(jī)應(yīng)對(duì)與應(yīng)急遞交機(jī)制 在公共衛(wèi)生緊急事件(如COVID-19)中,EMA允許簡(jiǎn)化eCTD序列,,優(yōu)先審評(píng)關(guān)鍵模塊并暫緩非數(shù)據(jù),。申請(qǐng)人可通過快速通道(Fast Track)提交疫苗或藥物的eCTD資料,審評(píng)周期可壓縮至6個(gè)月,。此類申請(qǐng)需附風(fēng)險(xiǎn)評(píng)估報(bào)告,,并承諾后續(xù)補(bǔ)交完整數(shù)據(jù)。 數(shù)據(jù)安全與長(zhǎng)期存檔 歐盟要求eCTD資料存檔期限至少為藥品上市后30年,,EMA采用分布式存儲(chǔ)和區(qū)塊鏈技術(shù)確保數(shù)據(jù)不可篡改,。申請(qǐng)人需定期備份本地副本,并使用符合GDPR要求的加密傳輸協(xié)議(如AS2)遞交,。歷史數(shù)據(jù)的遷移和格式轉(zhuǎn)換(如NeeS轉(zhuǎn)eCTD)需遵循特定技術(shù)規(guī)范,。 環(huán)保效益與可持續(xù)發(fā)展 eCTD取代紙質(zhì)遞交后,歐盟每年減少約500噸紙張消耗,,審評(píng)流程的數(shù)字化降低碳足跡約30%,。虛擬審評(píng)會(huì)議和電子簽名進(jìn)一步減少了差旅需求,契合歐盟2050碳中和目標(biāo),。未來,,eCTD4.0將通過數(shù)據(jù)壓縮技術(shù)進(jìn)一步降低服務(wù)器能耗。加拿大IND注冊(cè)申報(bào)相關(guān)技術(shù)支持,。
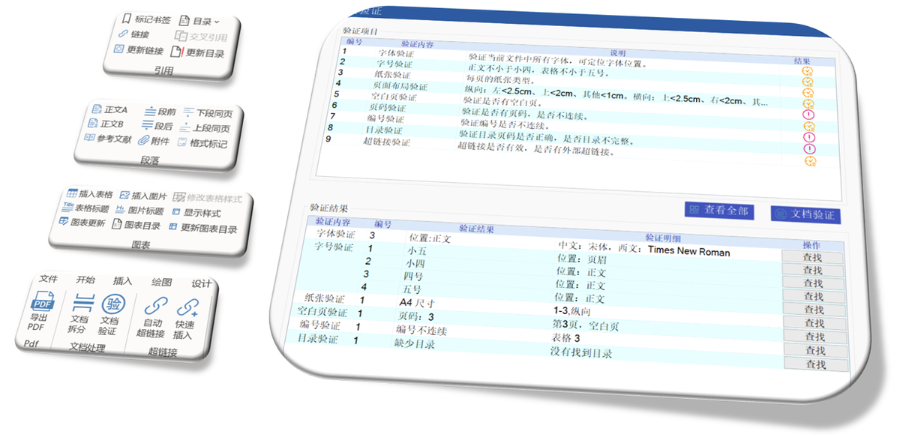
eCTD生命周期管理與變更提交:歐盟要求eCTD申報(bào)資料覆蓋藥品全生命周期,,包括提交、補(bǔ)充申請(qǐng)及實(shí)質(zhì)性變更,。例如,,增成員國(guó)需提交“附加成員國(guó)序列”,審評(píng)時(shí)間約52-83天,;重大變更(如生產(chǎn)工藝調(diào)整)需創(chuàng)建序列并通過CTIS平臺(tái)更模塊3和模塊1的GMP證明,。技術(shù)驗(yàn)證工具(如EDQM推薦的檢查軟件)需在每次提交前運(yùn)行,確保XML骨架文件與PDF書簽層級(jí)符合規(guī)范,。此外,,電子簽章需符合《歐盟電子簽名法》,并在模塊1中明確標(biāo)注法律效力,。歐洲通用提交門戶(Common European Submission Portal,,CESP)是歐盟及成員國(guó)藥品監(jiān)管機(jī)構(gòu)間用于電子化提交申報(bào)資料的重要平臺(tái)。以下是關(guān)于CESP的詳細(xì)介紹: CESP是由歐盟藥品監(jiān)管部門負(fù)責(zé)人網(wǎng)絡(luò)(HMA)合作開發(fā)的在線交付系統(tǒng),,旨在為藥品注冊(cè)申請(qǐng)者,、利益相關(guān)方和監(jiān)管機(jī)構(gòu)之間提供統(tǒng)一,、安全的電子提交通道。其設(shè)計(jì)初衷是簡(jiǎn)化跨國(guó)申報(bào)流程,,允許通過單一門戶向多個(gè)歐洲國(guó)家的藥監(jiān)部門同時(shí)提交申請(qǐng),,避免了重復(fù)操作。美國(guó)NDA注冊(cè)申報(bào)相關(guān)技術(shù)支持,。重慶eCTD報(bào)價(jià)
加拿大eCTD驗(yàn)證標(biāo)準(zhǔn)相關(guān)技術(shù)支持,。天津eCTD文件如何制作
ANDA遞交: 按照ICH M4的CTD格式整理資料,并以eCTD格式遞交,; 通過ESG通道遞交資料,; 收到CDER的letter,說明資料已經(jīng)進(jìn)入FDA數(shù)據(jù)庫(kù),; 付GDUFA費(fèi),,在資料遞交后的10日內(nèi)到賬; ANDA接收: 繳費(fèi)后,,F(xiàn)DA初步審查資料的完整性,,并會(huì)在60天給答復(fù)。 第一種情況是ANDA無缺陷,,F(xiàn)DA給申請(qǐng)人發(fā)受理信(Acceptance Letter),; 第二種情況是ANDA包含少于10個(gè)小缺陷,F(xiàn)DA將會(huì)通過電話,、傳真,、電子郵件等方式通知發(fā)布IR (信息請(qǐng)求函),讓申請(qǐng)人在7個(gè)日歷日內(nèi)改正,,若未按時(shí)補(bǔ)充所有需要的資料,,F(xiàn)DA將拒收該ANDA; 第三種情況是ANDA包含1個(gè)或者多個(gè)重大缺陷,,或10個(gè)以上的小缺陷,,F(xiàn)DA將拒收該ANDA,; 注:如果這邊被拒收,,只退75%的費(fèi)用。天津eCTD文件如何制作
- 高新區(qū)中國(guó)eCTD歡迎選購(gòu) 2025-05-14
- 靜安區(qū)生物制品eCTD使用 2025-05-14
- 蕪湖新藥eCTD是什么 2025-05-14
- 吳江區(qū)賦悅科技eCTD供應(yīng)商 2025-05-14
- 南京生物制品eCTD注冊(cè)系統(tǒng) 2025-05-14
- 上?;瘜W(xué)藥品eCTD格式 2025-05-09
- 南京電子申報(bào)eCTD哪個(gè)品牌好 2025-05-09
- 太倉(cāng)NDAeCTD服務(wù)價(jià)格 2025-05-09
- 浦東新區(qū)原料藥eCTD文件如何制作 2025-04-26
- 南京新藥eCTD找哪家 2025-04-26
- 濟(jì)寧化工設(shè)備管理系統(tǒng)公司 2025-06-19
- 泰州什么是訂單管理系統(tǒng)開發(fā) 2025-06-19
- 南京LED膠片掃描儀哪家好 2025-06-19
- 浦東新區(qū)社交平臺(tái)代運(yùn)營(yíng)哪家強(qiáng) 2025-06-19
- 蕪湖折彎上下料機(jī)器人 2025-06-19
- 廣州讀卡RFID模塊價(jià)格 2025-06-19
- 錫山區(qū)購(gòu)買氨綸高新技術(shù)化纖規(guī)格尺寸 2025-06-19
- 上海有機(jī)蜂蜜價(jià)錢 2025-06-19
- 三水區(qū)節(jié)能網(wǎng)絡(luò)布線功率 2025-06-19
- 寶山區(qū)質(zhì)量好的SMT加工廠有哪些 2025-06-19