陜西進(jìn)口高鹽核酸酶哪家公司銷售
監(jiān)管部門對HCD的殘留量有明確的規(guī)定,。美國FDA發(fā)布的指導(dǎo)原則中指出生物制品HCD殘余限度為 100pg/劑,對于大劑量生物制品如單克隆抗體,,根據(jù)其殘留DNA來源及給藥途徑,,殘留量可放寬至 10ng/劑。細(xì)胞基因藥物終產(chǎn)品的DNA殘留有兩種來源,,分別是宿主細(xì)胞DNA(HCD)和轉(zhuǎn)染用的質(zhì)粒,。質(zhì)粒和HCD的存在形式不同,去除效率也差別很大,。其中,,質(zhì)粒是裸露的DNA雙鏈,,帶強負(fù)電荷,通過色譜純化主要是離子交換能夠很高效去除,;HCD則是以核小體緊密折疊形成的染色質(zhì)形式存在,,幾乎不以裸DNA形式存在,所以很難去除,。宿主細(xì)胞DNA主要以染色質(zhì)形態(tài)存在,,其中的組蛋白通過離子相互作用及疏水相互作用與DNA緊密結(jié)合;陜西進(jìn)口高鹽核酸酶哪家公司銷售

一個美國客戶做了對照實驗,,比較Benzonase和SAN HQ高鹽核酸酶純化病毒載體的效率,。實驗設(shè)計如下,HEK293細(xì)胞轉(zhuǎn)染及培養(yǎng)后,,分別取了150Million的293細(xì)胞進(jìn)行裂解,,分別在各自適宜的條件下(即SAN HQ組反應(yīng)條件為500mM鹽濃度,而Benzonase組反應(yīng)條件是150mM鹽濃度)加入等量的酶(0,、2kU,、3kU、4kU,、5kU、6kU),,37°孵育1hr,,加入Picogreen染料后檢測DNA的殘留量。結(jié)果發(fā)現(xiàn),,SAN HQ高基因療法制造商面臨的挑戰(zhàn)與抗體療法剛出現(xiàn)時單克隆抗體制造商面臨的挑戰(zhàn)相似,。例如,在生產(chǎn),、儲存和處理過程中,,單克隆抗體也會受到低滴度、產(chǎn)品和工藝相關(guān)雜質(zhì)和降解的挑戰(zhàn),。盡管與重組單克隆抗體相比,,單劑量AAV產(chǎn)品與工藝相關(guān)雜質(zhì)相關(guān)的風(fēng)險可能更低(取決于雜質(zhì)的類型、劑量和給藥途徑),,但這也不能忽視,。由于這些相似性,制藥商,、化學(xué)品和輔料供應(yīng)商有機會進(jìn)行合作,,并開發(fā)創(chuàng)新的解決方案,以實現(xiàn)穩(wěn)健和成本效益高的AAV產(chǎn)品生產(chǎn),。鹽核酸酶組用更少的酶得到了更好的去除效果(即2kU的SAN HQ消化結(jié)果明顯優(yōu)于6kU的Benzonase),,且SAN HQ的高純化效率是非血清型依賴的,。云南70950-150高鹽核酸酶量大優(yōu)惠鑒于其在高鹽條件下的較高活性,SAN HQ高鹽核酸酶在不損失載體產(chǎn)量和活性的情況下改善了下游工藝,。
在不同的鹽濃度條件下,,AAV病毒載體的存在形式不同。低鹽濃度條件下,,AAV病毒顆粒表面會通過電荷作用等非特異結(jié)合到HCD上,,從而產(chǎn)生病毒顆粒團(tuán)聚現(xiàn)象。隨著溶液鹽濃度上升,,AAV病毒顆粒與HCD的離子相互作用會被破壞,,AAV病毒顆粒會逐漸解離。當(dāng)鹽濃度升到更高范圍(>400mM左右),,AAV病毒顆粒與HCD的結(jié)合更弱,,AAV顆粒更穩(wěn)定。因此,,在高鹽濃度溶液中,,AAV顆粒更加穩(wěn)定,且有數(shù)據(jù)表明高鹽濃度不會削弱AAV的侵染能力,。所以,,我們推薦提高AAV病毒生產(chǎn)中的鹽濃度。
從國內(nèi)來看,,由于 AAV 基因藥物研發(fā)管線絕大部分集中在眼科遺傳病上,,載體用量較小,三質(zhì)粒共轉(zhuǎn)染 AAV 系統(tǒng)足以滿足未來的臨床及商業(yè)需求,,因此,,國內(nèi)的 AAV 生產(chǎn)系統(tǒng)主要以三質(zhì)粒為主。然而,,考慮到未來 AAV 基因藥物在血液,、神經(jīng)系統(tǒng)、肌肉系統(tǒng)等領(lǐng)域的臨床應(yīng)用,,三質(zhì)粒系統(tǒng)顯然難以勝任,。如藥明生基從國外收購了 OXGENE 的輔助腺病毒 AAV 生產(chǎn)系統(tǒng) TESSA,據(jù)報道較三質(zhì)粒系統(tǒng)有10倍的提升,;而基因藥物 CDMO 企業(yè)北京五加和基因則在國內(nèi)率先采用了陳海峰博士的威洛克公司授權(quán)的Bac-to-AAV 系統(tǒng),,憑借公司在病毒載體領(lǐng)域持續(xù)30年的研發(fā)經(jīng)驗,不斷摸索,、試驗,,終于在臨床級生產(chǎn)方面獲得了巨大的成功,為 AAV 基因藥物管線研發(fā)公司錦籃基因進(jìn)行多批次臨床 CDMO 代工生產(chǎn)。上海高鹽核酸酶產(chǎn)品質(zhì)量哪家好呢,,歡迎咨詢上海倍篤生物 ,。
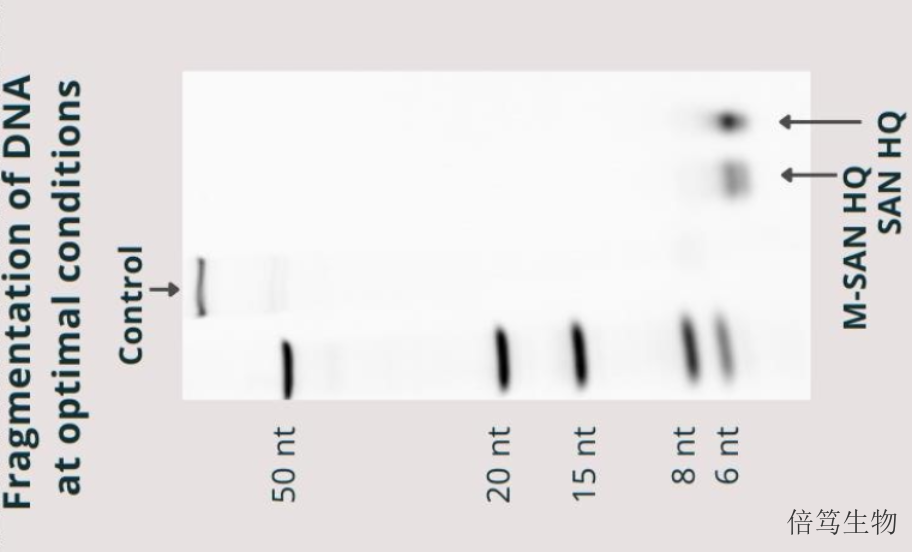
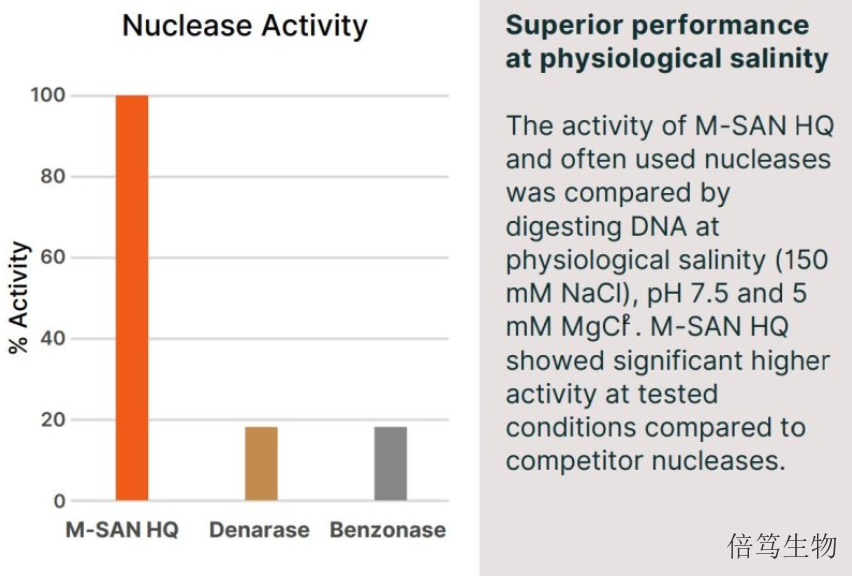
ArcticZymes Technologies有兩條產(chǎn)品線,分別針對分子診斷和生物藥物生產(chǎn)兩個領(lǐng)域,。在分子診斷領(lǐng)域,,產(chǎn)品有蝦堿酶(SAP)、UNG酶,、等溫擴增酶(IsoPol),、連接酶、蛋白酶,、內(nèi)切核酸酶及外切核酸酶等,,涉及核酸抽提、擴增及測序等應(yīng)用,。在生物藥物生產(chǎn)領(lǐng)域,,全球創(chuàng)新的鹽活性核酸酶(Salt Active Nucleases, SANs)系列產(chǎn)品以其獨特優(yōu)勢,在細(xì)胞基因藥物及RNA藥物生產(chǎn)中表現(xiàn)出更好的性能,。其中,,鹽活性核酸酶SANs系列產(chǎn)品包含兩款產(chǎn)品,分別是SAN HQ高鹽核酸酶和M-SAN HQ中鹽核酸酶,;兩款酶的差別在于發(fā)揮酶活的鹽濃度范圍分別是生理鹽濃度范圍和400-600mM高鹽濃度范圍,。SAN HQ高鹽核酸酶有兩個級別,分別是生物工藝級別SAN HQ和GMP級別SAN HQ GMP,。云南70950-150高鹽核酸酶量大優(yōu)惠
衢州高鹽核酸酶售后服務(wù)哪家好呢,,歡迎咨詢上海倍篤生物 。陜西進(jìn)口高鹽核酸酶哪家公司銷售
由于Triton X-100的降解產(chǎn)物對環(huán)境影響很大,,自2023年12月22日起,歐盟將禁止使用Triton X-100生產(chǎn)試驗性醫(yī)療產(chǎn)品等,。請注意,,含有≤0.1% (w/w) Triton X-100表面活性劑的物質(zhì)不被視為危險物質(zhì),仍然可以進(jìn)口到歐洲,。由于該產(chǎn)品通常不用作生物制品或先進(jìn)療法的賦形劑,,因此在歐洲以外生產(chǎn)的大多數(shù)藥物在其開發(fā)商考慮在歐盟生產(chǎn)之前不需要生產(chǎn)變更。此外,,已經(jīng)獲得許可的藥物及其賦形劑不受該規(guī)則約束,。所有其它希望在歐盟生產(chǎn)生物藥物和研究產(chǎn)品的生產(chǎn)商都必須尋求Triton X-100的替代品并驗證它們對各自用途的適用性。為了支持客戶項目更好在歐盟區(qū)域申報上市,,ArcticZymes Technologies于2019年推出了Triton X-100 Free的SAN HQ TF高鹽核酸酶,。與SAN HQ高鹽核酸酶相比,SAN HQ TF用Tween-20替代了Triton X-100,酶活性能完全一致,。目前,,SAN HQ和SAN HQ TF都有項目在臨床階段,相關(guān)性能都得到了行業(yè)客戶的認(rèn)可,。陜西進(jìn)口高鹽核酸酶哪家公司銷售
- 四川效果中鹽核酸酶銷售電話 2025-06-24
- 湖北智能中鹽核酸酶銷售電話 2025-06-24
- 天津綜合中鹽核酸酶聯(lián)系方式 2025-06-24
- 吉林倍篤生物高鹽核酸酶用途 2025-06-24
- 江蘇在線中鹽核酸酶聯(lián)系方式 2025-06-24
- 海南進(jìn)口中鹽核酸酶廠家直銷 2025-06-24
- 湖北需求高鹽核酸酶聯(lián)系方式 2025-06-24
- 北京質(zhì)量高鹽核酸酶 2025-06-24
- 海南M-SAN HQ中鹽核酸酶銷售電話 2025-06-24
- 杭州SAN HQ高鹽核酸酶代理商 2025-06-24
- 自主研發(fā)步態(tài)評估服務(wù)電話 2025-06-24
- 黃浦區(qū)是什么醫(yī)療管理服務(wù)主題 2025-06-24
- 遼寧DPC十二烷基磷酸膽堿鼻噴制劑 2025-06-24
- 北京專業(yè)ELISA試劑盒價位 2025-06-24
- 河南4K錄像醫(yī)用刻錄機生產(chǎn)廠家 2025-06-24
- 安徽培養(yǎng)基一次性生物耗材廠家價格 2025-06-24
- 河北全腸道菌群檢測哪家好 2025-06-24
- 江蘇太空艙按摩椅批發(fā)廠家 2025-06-24
- 成都洗鼻鹽批發(fā)價 2025-06-24
- 北京包含什么ELISA試劑盒電話多少 2025-06-24