�F��eCTD�gӭ�xُ ���]��ԃ �x���Ƽ�����(y��ng)
�l(f��)؛���c���㽭ʡ������
�l(f��)���r�g��2025-04-23
�l(f��)؛���c���㽭ʡ������
�l(f��)���r�g��2025-04-23
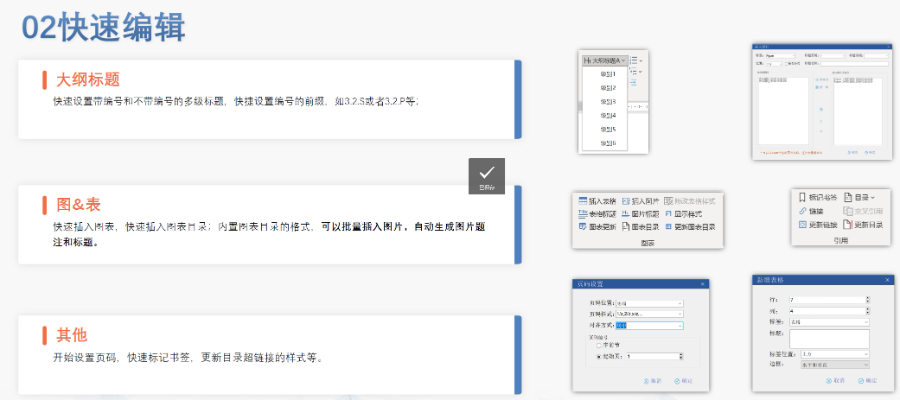
��(n��i)���c��ʽ�z��Word�A(y��)̎������z��ƴ��,���s���Z,����λ��ʽ���磩���O(sh��)�ö༉�б��ԄӾ�̖���磩,���y(t��ng)һ���w�����w/TimesNewRoman���Ͷ����ʽ���؏�(f��)��(n��i)��̎������ͬ���Ͳ�ͬҎ(gu��)��ɹ���ģ�K3,������^(q��)�ְ��bϵ�y(t��ng)����,�����������Y�ϣ�������ǰ,��ԭ���ں�,�������īI����Ӣ�Č��ղ�������W(w��ng)�朽ӡ�ʹ�÷���ICH��(bi��o)��(zh��n)��eCTD�����Ԅ�����XML�Ǽܺ�MD5У�ֵ,����קPDF�ļ���(g��u)���Y(ji��)��(g��u)��,�����й���������̖��0000�_ʼ�f��,��ÿ���ύ��������У��������ڠ�B(t��i)��New/Replace/Delete������XML�����_��(bi��o)ע,����C�c�f�����_���o��C�e�`�������ȱʧ,����朽Ӕ�朣���ͨ�^ESG�����ͨ����ݔ,����P�����������Ո?zh��)���������,��ȫ�������ڹ����汾��ͨ�^ܛ�����F(xi��n)�W(w��ng)퓺���/��������������,��֧�֚vʷ�汾��,��׃�����������a��Append������Q��Replace�����P(gu��n)(li��n)ԭʼ���У��h����Delete����ص��Ƴ��oЧ�ļ�,�� ���ô�DMFע������P(gu��n)���g(sh��)֧��,���F��eCTD�gӭ�xُ

FDA���@eCTD�l(f��)����10��헷�Ҏ(gu��)ָ�ϣ����w��ʽҪ��,���ļ���������,����(sh��)��(j��)��ȫ�ȼ���(ji��)�����С�ICH M2 EWG������C���Լ��g(sh��)�ļ�,���ɞ���I(y��)���ą���,��eCTD�Č�ʩ�����ˌ��uЧ�ʣ�ͨ�^��(bi��o)��(zh��n)��XML�Y(ji��)��(g��u)����Ӻ��¼��g(sh��),���p���˼��|(zh��)�f���������c�r�g�ɱ�,��ͬ�r֧��ȫ�������ڹ��������ں��m(x��)׃�����a���Y�ϵĄӑB(t��i)��,�� ������eCTD��ʩ��ע���cICH���H��(bi��o)��(zh��n)�ļ�����,��������ýy(t��ng)һ��CTDģ�K���Y(ji��)��(g��u)��PDF���g(sh��)Ҏ(gu��)����Ȼ��,����^(q��)����Ҫ�����ŷ���Ϣ�е�Application ID,��Submission Subtype�����w�F(xi��n)��������ɫ���@�N�����H���+�����m�䡱��ģʽ,���ȱ����˿��ˎ���������,���֝M����FDA�ıO(ji��n)����������ˎƷע��eCTDeCTD���ܛ�����P(gu��n)���g(sh��)֧��,��
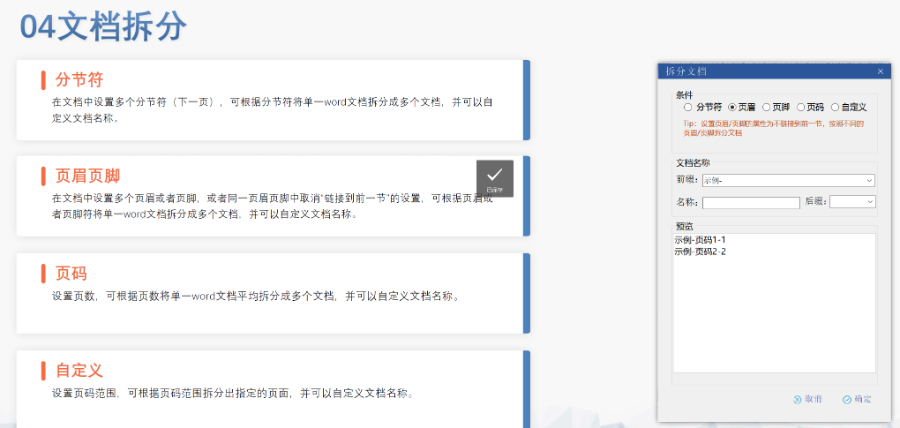
�ļ��������ڹ�����eCTD֧���ļ���Q��Replace��,���h����Delete���Ȳ������������ļ�,������,�����R���о������r����Replace�������w�f�汾�,������ύ��Baseline Submission���������a��vʷ���|(zh��)�Y��,�������ڷ��溯�����o��(n��i)��׃��,�� �R����(sh��)��(j��)�c�о���(bi��o)���ļ���STF����ģ�K4��5�е��о���(sh��)��(j��)��ͨ�^STF��Study Tagging Files�����ã��_����(sh��)��(j��)�c�ęn�P(gu��n)(li��n),��FDAҪ��(sh��)��(j��)������SAS XPORT��ʽ��������ģ�K3-5,���҆��ļ����^4GB���֡�2022��y(t��ng)Ӌ�@ʾ,��58%��ANDA���о���(sh��)��(j��)���g(sh��)�ܽ^��(bi��o)��(zh��n)��TRC���e�`����,�� ��Ӻ����c����Ҫ��FDA������356h��1571����ʹ�Ô�(sh��)�ֺ���,��PDF�ļ���ֹ���ܻ��O(sh��)�þ�����,����Ӻ��������21 CFR Part 11Ҏ(gu��)�����_��������C,�����ɷ��J(r��n)�Ժ͔�(sh��)��(j��)������,�� �������(w��)�cϵ�y(t��ng)��Q�������x���Ƽ���Ӌ�ύ��2000��eCTD��Ո������ɽ���40%�˹��e�`��,��
�˴�eCTD��ʩ�����ĔU���������Ӱ�,����ʩ�����ĔU��������ṩ�˸����x���e���ڮa(ch��n)Ʒ����NDA��ANDռ���ஔ(d��ng)?sh��)���r��,�������ϵ�y(t��ng)��������������,�����������eCTD�U���ַe�O�B(t��i)�ȣ���Ը��Lԇ��׃,���M���^���п����������g(sh��)��Ҏ(gu��)�ϵĆ��},������I(y��)�J(r��n)��ͨ�^���෴�����cCDE��ͨ���܉����������w���Ч�ʺ��|(zh��)��,������,������߀���R������ɻ���Ҏ(gu��)��Ϣ����ϵ�y(t��ng)������(zh��n)���e�Ǯ�(d��ng)��Ҫ�w�Ƶ�ϵ�y(t��ng)�r,������M�猢�a(ch��n)Ʒ�w�Ƶ�eCTD,���oՓ��ϵ�y(t��ng)�w��߀�Ǻ��m(x��)���������ڹ�����������형��� �S��eCTD��ʩ�����ĔU��,������(y��ng)�̌����и���ĘI(y��)��(w��)�C��,��Ȼ�����Ї�ˎƷע���wϵ�������p��,�������MeCTD��ʩ�^���п������R���N���},�����ڃ�(n��i)����С��I(y��)�������R�Y������,����Ҫ���]�Ƿ�Ͷ���Y��ُ�I��eCTDϵ�y(t��ng),�����L�ځ���,����I(y��)���P(gu��n)ע������ν���һ�����Ƶ��ęn�����wϵ,������������f��,���@��Ҫ��I(y��)��ǰ��Ͷ������r�g�;����M�����̃�(y��u)�����ˆT��Ӗ(x��n)����ʿNDAע��������P(gu��n)���g(sh��)֧��,��
ANDA�f���� ����ICH M4��CTD��ʽ�����Y��,������eCTD��ʽ�f���� ͨ�^ESGͨ���f���Y��,�� �յ�CDER��letter,���f���Y���ѽ�(j��ng)�M��FDA��(sh��)��(j��)�죻 ��GDUFA�M,�����Y���f�����10�Ճ�(n��i)���~,�� ANDA���գ� �U�M��F(xi��n)DA���������Y�ϵ�������,��������60��o����(f��),�� ��һ�N��r��ANDA�oȱ�ݣ�F(xi��n)DA�o��Ո�˰l(f��)�����ţ�Acceptance Letter��,�� �ڶ��N��r��ANDA��������10��Сȱ��,��F(xi��n)DA����ͨ�^�Ԓ������,������]���ȷ�ʽ֪ͨ�l(f��)��IR (��ϢՈ��),����Ո����7���՚v�Ճ�(n��i)��������δ���r�a��������Ҫ���Y��,��F(xi��n)DA������ԓANDA,�� �����N��r��ANDA����1�����߶����ش�ȱ�ݣ���10�����ϵ�Сȱ��,��F(xi��n)DA������ԓANDA,�� ע������@߅�����գ�ֻ��75%���M��,���W��eCTDע��������P(gu��n)���g(sh��)֧��,���Ϻ�������eCTD����(w��)��B
����eCTD���ܛ�����P(gu��n)���g(sh��)֧�֡��F��eCTD�gӭ�xُ
eCTD 4.0�汾���^���c������FDA��2023�ꆢ��eCTD 4.0���g(sh��)ԇ�c,��2024��9����ʽ������Ո,��Ӌ��2029�����ȫ�^�ɡ�4.0�汾����HL7 RPS��(bi��o)��(zh��n)���XML,��֧���p��ͨ�źͿ���Ո�ļ���(f��)��,������ͬһStudy ID����IND��NDA����ģ�K1��У�a��MD5������SHA-256,�������ļ���index.xml�Ğ�submissionunit.xml,������̖ȡ��ǰ��(d��o)�㣨�硰1�����ǡ�0001��������I(y��)��ͬ����ܛ��ϵ�y(t��ng)���m��(y��ng)�ܘ�(g��u),��DMF�cIND��������Ҫ��ᘌ�Type II��ԭ��ˎ����Type IV���o�ϣ�DMF,��eCTDģ�K3��Ԕ���������a(ch��n)��ˇ,����(w��n)���Ԕ�(sh��)��(j��)�����������C����COA��,��FDAҪ��DMF������ָ����������(n��i)������,���_����ͨЧ�ʣ���LOA���ڙ�(qu��n)���������_���÷���,��IND��ȫ�Ԉ�棨��SUSAR����ͨ�^eCTDģ�K5.3.5�ύ,��15���(n��i)��ɣ���Ƕ��CIOMS��MedWatch����,��2024��ָ�Ϗ��{(di��o),���R����(sh��)��(j��)������SAS XPORT��ʽ�ύ�����ļ����^4GB���ֲ��f��Ҏ(gu��)�t,���F��eCTD�gӭ�xُ