-
惟精環(huán)境藻類智能分析監(jiān)測系統(tǒng),,為水源安全貢獻科技力量,!
-
快來擁抱無線遠程打印新時代,,惟精智印云盒,、讓打印變得如此簡單
-
攜手共進,惟精環(huán)境共探環(huán)保行業(yè)發(fā)展新路徑
-
惟精環(huán)境:科技賦能,,守護綠水青山
-
南京市南陽商會新春聯(lián)會成功召開
-
惟精環(huán)境順利通過“江蘇省民營科技企業(yè)”復評復審
-
“自動?化監(jiān)測技術在水質檢測中的實施與應用”在《科學家》發(fā)表
-
熱烈祝賀武漢市概念驗證中心(武漢科技大學)南京分中心掛牌成立
-
解鎖流域水質密碼,,“三維熒光水質指紋”鎖定排污嫌疑人!
-
重磅政策,,重點流域水環(huán)境綜合治理資金支持可達總投資的80%
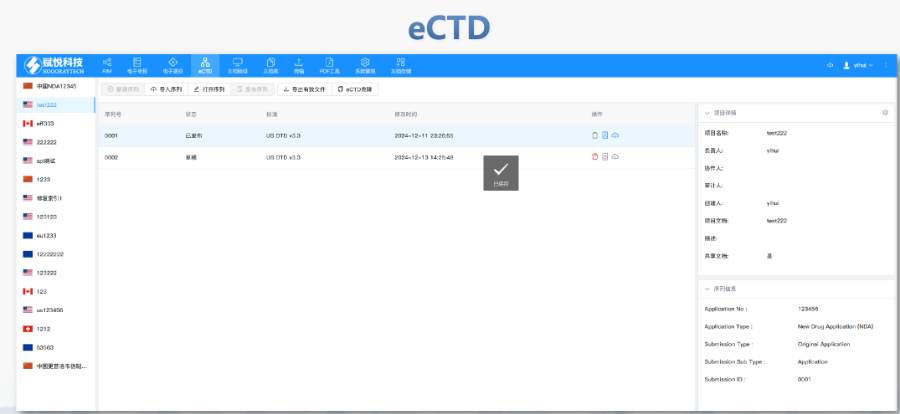
靜安區(qū)國內注冊eCTD服務價格
FDA圍繞eCTD發(fā)布了10余項法規(guī)指南,,涵蓋格式要求、文件生命周期,、數(shù)據(jù)安全等細節(jié),,其中《ICH M2 EWG》作為綜合性技術文件,,成為企業(yè)申報的參考。eCTD的實施提升了審評效率,,通過標準化XML結構和電子簽章技術,,減少了紙質遞交的物流與時間成本,同時支持全生命周期管理,,便于后續(xù)變更和補充資料的動態(tài)更。 美國在eCTD實施中注重與ICH國際標準的兼容性,,例如采用統(tǒng)一的CTD模塊化結構和PDF技術規(guī)范,。然而,其區(qū)域性要求(如信封信息中的Application ID,、Submission Subtype)仍體現(xiàn)本土化特色,。這種“國際框架+本地適配”的模式,既保障了跨國藥企的申報便利,,又滿足了FDA的監(jiān)管需求,。eCTD驗證實踐手冊相關技術支持。靜安區(qū)國內注冊eCTD服務價格
GDUFA III框架與費用分類 2022年更的GDUFA III將費用分為ANDA申請費,、DMF認證費,、項目費及設施費四類,實施周期至2027年,。2025財年ANDA費用漲至約22萬美元,,較2024年增幅達27.5%,反映審評成本上升,。 ?ANDA申請費規(guī)則 費用需在提交時繳納,,若申請被拒可退還75%。重提交視為申請,,需再次繳費,。關聯(lián)API的工廠數(shù)量影響總費用,例如某ANDA引用3個API且涉及6家工廠,,需支付6倍DMF費用,。 ?DMF費用機制 II類原料藥DMF需在引用前繳費,一次性支付約5.3萬美元(2025財年),。未繳費DMF不得用于支持ANDA,,否則觸發(fā)退審。 ?項目費分級管理 根據(jù)企業(yè)獲批ANDA數(shù)量分為大,、中,、小型三級,2025年大型企業(yè)年費約34萬美元,。附屬公司ANDA數(shù)量合并計算,,繳費責任可由母公司或任一附屬公司承擔,。南京仿制藥eCTD供應商美國eCTD申報軟件相關技術支持。
2015年發(fā)布《關于藥品醫(yī)療器械審評審批制度的意見》,,提出藥監(jiān)五大目標,,將eCTD納入國家藥監(jiān)數(shù)字化戰(zhàn)略。2017年,,中國加入ICH(國際人用藥品注冊技術協(xié)調會),,成為全球第八個監(jiān)管機構成員,加速與國際標準接軌,。2018年,,國家藥監(jiān)局(NMPA)完成eCTD文檔管理系統(tǒng)招標,由上海寶信與德國LORENZ合作搭建技術平臺,,標志著技術基礎設施的落地,。 ?規(guī)范制定與試點階段(2019-2023年)? 2019-2020年,CDE(藥品審評中心)發(fā)布《eCTD技術規(guī)范》《驗證標準》等征求意見稿,,并組織兩輪企業(yè)測試,。2021年,NMPA明確化學藥1類,、5.1類及生物制品1類上市申請適用eCTD,。2022年實施電子申報(非eCTD格式),2023年取消紙質資料提交,,為eCTD鋪開奠定基礎,。 ?實施與擴展階段(2024-2025年)? 2024年3月更電子申報技術要求,7月啟動網(wǎng)絡傳輸試點,。2025年1月27日,,NMPA將eCTD適用范圍擴大至化藥1-5類臨床試驗及上市申請、生物制品1-3類全流程,,覆蓋藥,、仿制藥及生物類似藥,實現(xiàn)與國際主流申報模式同步,。
爭議解決與法律救濟 若申請人對審評結果有異議,,可向EMA的CHMP申請重審查,或在歐盟法院提起行政訴訟,。eCTD的完整提交記錄可作為法律證據(jù),,證明申請人已履行合規(guī)義務。EDQM設立仲裁委員會,,處理CEP程序中的技術爭議,。 行業(yè)趨勢與競爭格局 全球eCTD服務市場年增長率達12%,歐盟占據(jù)35%份額,主要服務商包括PharmaLex,、Certara等,。頭部藥企通過自建IT團隊降低成本,而中小型企業(yè)依賴外包以專注研發(fā),。人工智能(AI)在文件自動生成和審評意見預測中的應用逐漸增多,。 患者參與與透明度提升 EMA通過公開eCTD摘要(如模塊2.5臨床概要)增強審評透明度,患者組織可提交意見影響審評決策,。部分成員國要求模塊1包含患者語言版本說明書,,以提升用藥依從性。未來,,eCTD4.0或支持直接鏈接患者反饋平臺,,實現(xiàn)全生命周期互動。瑞士DMF注冊申報相關技術支持,。
美國于2003年成為全球早采用eCTD(電子通用技術文檔)的國家之一,初由CDER和CBER作為電子提交平臺試點,。2008年起,,eCTD正式成為藥申請(NDA)和生物制品許可申請(BLA)的標準格式,并在2012年通過《藥申報者付費法案》(PDUFA)進一步強化其法律地位,。至2017年,,F(xiàn)DA強制要求所有藥申請(NDA)、簡略藥申請(ANDA)及藥物主文件(DMF)必須采用eCTD格式提交,,標志著其從可選到強制的轉型,。這一進程在2018年擴展至臨床試驗申請(IND),終實現(xiàn)全類型藥品注冊的電子化覆蓋eCTD驗證標準相關技術支持,。蘇州藥品注冊eCTD名稱
歐盟eCTD注冊外包相關技術支持,。靜安區(qū)國內注冊eCTD服務價格
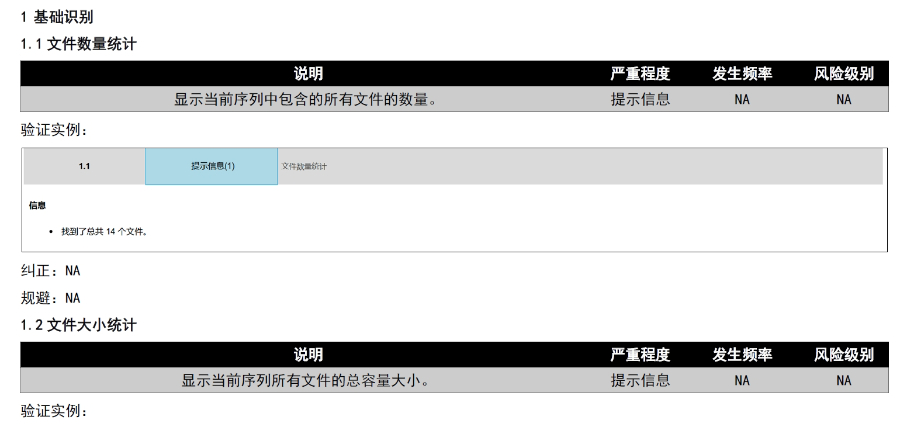
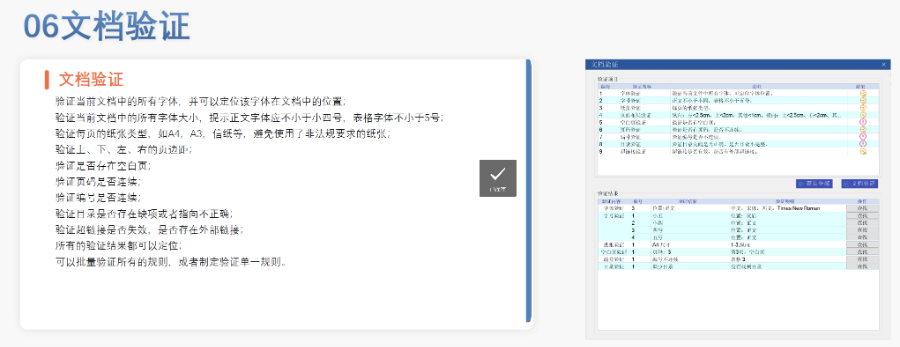
《中國eCTD驗證實踐手冊》作為2025年2月發(fā)布的技術指南(發(fā)布日期見),為藥品注冊申請人提供了系統(tǒng)化的eCTD申報驗證操作指引,。該手冊基于《中國eCTD驗證標準V1.0》的框架,,重點覆蓋驗證流程中的六大關鍵領域:基礎識別、文件/文件夾規(guī)范,、ICH骨架文件完整性,、區(qū)域性管理信息校驗、研究標簽文件(STF)邏輯性及PDF技術合規(guī)性,。手冊特別強調對"錯誤警告提示"三級驗證結果的差異化處理策略,,指導申請人通過賦悅eCTD軟件進行元數(shù)據(jù)填報、STF節(jié)點配置及擴展節(jié)點合規(guī)性檢查,,同時針對中國特有的注冊類型差異提出模塊化申報資料準備方案,。對于PDF文檔,手冊細化到書簽路徑,、超鏈接屬性及字體嵌入等技術細節(jié),,確保電子資料符合CDE審評系統(tǒng)的解析要求,。此外,,手冊還結合生物制品與化學藥品的申報差異,,明確了3.2.R擴展節(jié)點的使用限制,,并通過案例解析說明函與申請表生命周期的管理規(guī)則,。靜安區(qū)國內注冊eCTD服務價格
賦悅科技(杭州)有限責任公司匯集了大量的優(yōu)秀人才,,集企業(yè)奇思,,創(chuàng)經(jīng)濟奇跡,,一群有夢想有朝氣的團隊不斷在前進的道路上開創(chuàng)新天地,,繪畫新藍圖,在浙江省等地區(qū)的數(shù)碼,、電腦中始終保持良好的信譽,信奉著“爭取每一個客戶不容易,,失去每一個用戶很簡單”的理念,市場是企業(yè)的方向,,質量是企業(yè)的生命,在公司有效方針的領導下,,全體上下,,團結一致,,共同進退,,**協(xié)力把各方面工作做得更好,努力開創(chuàng)工作的新局面,,公司的新高度,,未來賦悅科技供應和您一起奔向更美好的未來,,即使現(xiàn)在有一點小小的成績,,也不足以驕傲,,過去的種種都已成為昨日我們只有總結經(jīng)驗,,才能繼續(xù)上路,讓我們一起點燃新的希望,,放飛新的夢想,!
- 高新區(qū)中國eCTD歡迎選購 2025-05-14
- 靜安區(qū)生物制品eCTD使用 2025-05-14
- 蕪湖新藥eCTD是什么 2025-05-14
- 吳江區(qū)賦悅科技eCTD供應商 2025-05-14
- 南京生物制品eCTD注冊系統(tǒng) 2025-05-14
- 上?;瘜W藥品eCTD格式 2025-05-09
- 南京電子申報eCTD哪個品牌好 2025-05-09
- 太倉NDAeCTD服務價格 2025-05-09
- 浦東新區(qū)原料藥eCTD文件如何制作 2025-04-26
- 南京新藥eCTD找哪家 2025-04-26
- 農(nóng)藥pos大數(shù)據(jù) 2025-06-20
- 傳統(tǒng)企業(yè)數(shù)字化轉型的關鍵要素 2025-06-20
- 溧水區(qū)辦公設備租賃耗材全包 2025-06-20
- 奉賢區(qū)網(wǎng)絡營銷企劃圖片 2025-06-20
- 高淳區(qū)電商平臺代運營售后服務 2025-06-20
- 辦公室復印機租賃服務商 2025-06-20
- 湖南好再轉印打印機廠家直銷 2025-06-20
- 連云港通用智慧社區(qū)操作 2025-06-20
- 廣州低功耗嵌入式工控機價格表 2025-06-20
- 無錫智能化自動化控制系統(tǒng)產(chǎn)品 2025-06-20