美國于2003年成為全球早采用eCTD(電子通用技術(shù)文檔)的國家之一,,初由CDER和CBER作為電子提交平臺試點,。2008年起,eCTD正式成為藥申請(NDA)和生物制品許可申請(BLA)的標(biāo)準(zhǔn)格式,,并在2012年通過《藥申報者付費法案》(PDUFA)進一步強化其法律地位,。至2017年,F(xiàn)DA強制要求所有藥申請(NDA),、簡略藥申請(ANDA)及藥物主文件(DMF)必須采用eCTD格式提交,,標(biāo)志著其從可選到強制的轉(zhuǎn)型。這一進程在2018年擴展至臨床試驗申請(IND),,終實現(xiàn)全類型藥品注冊的電子化覆蓋中NDA注冊申報相關(guān)技術(shù)支持,。北京DMFeCTD
法規(guī)文檔管理系統(tǒng) 協(xié)同共享 RDMS可以讓跨區(qū)域、跨部門協(xié)同真正成為1+1>2的 工作,。讓頻繁的文檔共享傳輸,,版本管理,生命周 期審批都變得輕松簡單 安全合規(guī) 通過詳細(xì)的審計追蹤,、電子簽名,、權(quán)限管理、網(wǎng) 關(guān)控制,、頁面控制等技術(shù)手段,,構(gòu)建安全合規(guī)的 文檔管理系統(tǒng),通過安全驗證與合規(guī)驗證 統(tǒng)一文檔來源 藥品注冊是企業(yè)經(jīng)營成果的技術(shù)資料,,由多個部門 長時間匯集到法規(guī)部門,。RDMS確保多部門文檔來 源統(tǒng)一,即使人員流動也可以快速接續(xù)工作 統(tǒng)一文檔結(jié)構(gòu) 根據(jù)不同申報類型,,自動生成文檔結(jié)構(gòu),,讓法規(guī) 人員與跨部門同事掌握申報需要的資料需求,降 低溝通成本,,降低經(jīng)驗需求,,避免疏忽遺漏安徽仿制藥eCTD哪個品牌好瑞士IND注冊申報相關(guān)技術(shù)支持。
文件生命周期管理:eCTD支持文件替換(Replace),、刪除(Delete)等操作,,而非增文件。例如,,更臨床研究方案時需用Replace操作覆蓋舊版本,。基線提交(Baseline Submission)可用于補充歷史紙質(zhì)資料,,但需在封面函中聲明無內(nèi)容變更,。 臨床數(shù)據(jù)與研究標(biāo)簽文件(STF):模塊4和5中的研究數(shù)據(jù)需通過STF(Study Tagging Files)引用,,確保數(shù)據(jù)與文檔關(guān)聯(lián)。FDA要求數(shù)據(jù)集(如SAS XPORT格式)能置于模塊3-5,,且單個文件超過4GB需拆分,。2022年統(tǒng)計顯示,58%的ANDA因研究數(shù)據(jù)技術(shù)拒絕標(biāo)準(zhǔn)(TRC)錯誤被拒,。 電子簽名與表格要求:FDA表格(如356h,、1571)需使用數(shù)字簽名,PDF文件禁止加密或設(shè)置編輯限制,。電子簽名需符合21 CFR Part 11規(guī)范,,確保身份驗證、不可否認(rèn)性和數(shù)據(jù)完整性,。 外包服務(wù)與系統(tǒng)解決方案:賦悅科技累計提交超2000份eCTD申請,,外包可降低40%人工錯誤率。
從紙質(zhì)到電子的歷史過渡 2017年前,,美國允許紙質(zhì)與eCTD并行提交,,但此后逐步淘汰紙質(zhì)通道,保留緊急情況下的例外審批,。2020年電子化后,,所有IND、NDA,、ANDA和DMF強制采用eCTD格式。 系統(tǒng)平臺升級 FDA通過“藥品業(yè)務(wù)應(yīng)用系統(tǒng)”和“藥品eCTD注冊系統(tǒng)”實現(xiàn)電子資料接收,、受理與審評的全流程數(shù)字化,。2022年系統(tǒng)增自動推送受理文書和短信提醒功能,減少人工干預(yù),。 電子文檔結(jié)構(gòu)優(yōu)化 美國eCTD采用分層文件夾結(jié)構(gòu),,例如化學(xué)藥品的模塊1-5分別對應(yīng)行政文件、總結(jié)報告,、質(zhì)量數(shù)據(jù)等,。2020年后增“臨床試驗數(shù)據(jù)庫”裝盒要求,強化數(shù)據(jù)可追溯性,。中IND注冊申報相關(guān)技術(shù)支持,。

2015年發(fā)布《關(guān)于藥品醫(yī)療器械審評審批制度的意見》,提出藥監(jiān)五大目標(biāo),,將eCTD納入國家藥監(jiān)數(shù)字化戰(zhàn)略,。2017年,中國加入ICH(國際人用藥品注冊技術(shù)協(xié)調(diào)會),,成為全球第八個監(jiān)管機構(gòu)成員,,加速與國際標(biāo)準(zhǔn)接軌,。2018年,國家藥監(jiān)局(NMPA)完成eCTD文檔管理系統(tǒng)招標(biāo),,由上海寶信與德國LORENZ合作搭建技術(shù)平臺,,標(biāo)志著技術(shù)基礎(chǔ)設(shè)施的落地。 規(guī)范制定與試點階段(2019-2023年) 2019-2020年,,CDE(藥品審評中心)發(fā)布《eCTD技術(shù)規(guī)范》《驗證標(biāo)準(zhǔn)》等征求意見稿,,并組織兩輪企業(yè)測試。2021年,,NMPA明確化學(xué)藥1類,、5.1類及生物制品1類上市申請適用eCTD。2022年實施電子申報(非eCTD格式),,2023年取消紙質(zhì)資料提交,,為eCTD鋪開奠定基礎(chǔ)。 實施與擴展階段(2024-2025年) 2024年3月更電子申報技術(shù)要求,,7月啟動網(wǎng)絡(luò)傳輸試點,。2025年1月27日,NMPA將eCTD適用范圍擴大至化藥1-5類臨床試驗及上市申請,、生物制品1-3類全流程,,覆蓋藥、仿制藥及生物類似藥,,實現(xiàn)與國際主流申報模式同步,。加拿大eCTD注冊外包相關(guān)技術(shù)支持。中國臺灣生物制品eCTD
加拿大NDA注冊申報相關(guān)技術(shù)支持,。北京DMFeCTD
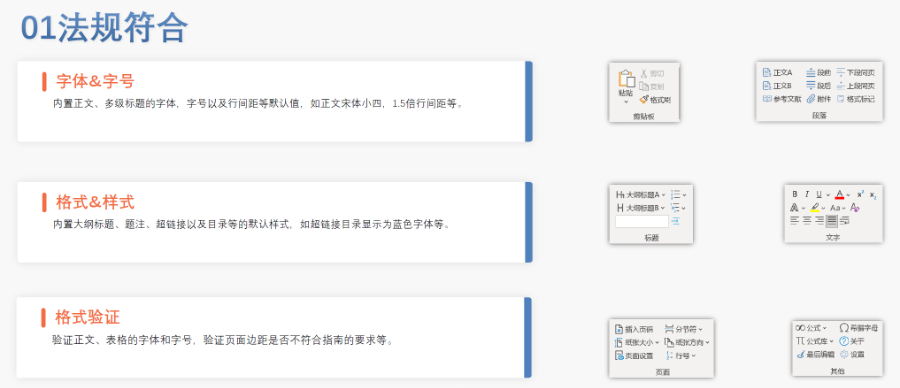
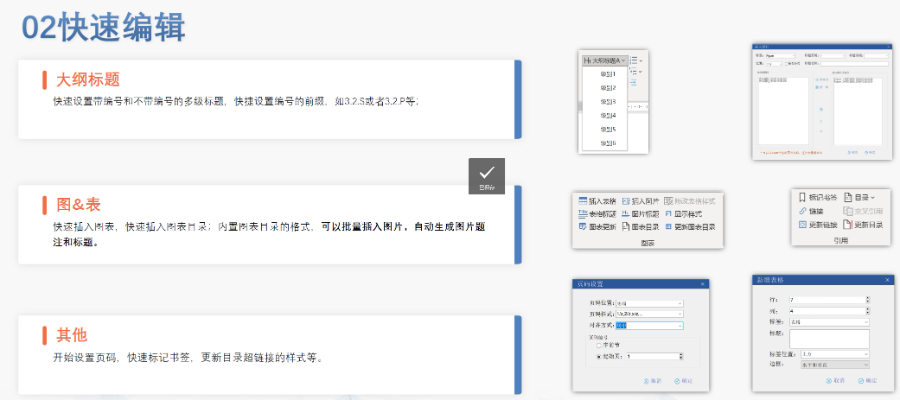
賦悅Word插件 自主研發(fā)Word插件 快速編輯:整合word常用功能按鈕,,避免頻繁切換菜單;內(nèi)置標(biāo)題,、段落,、文字、目錄,、超鏈接等的格式和樣式,,可快速設(shè)置和更文檔的格式 快速鏈接:雙擊或者拖拽的方式,制作文本超鏈接或者題注超鏈接,;可搜索全文關(guān)鍵字,,自動制作超鏈接 文檔拆分:可根據(jù)不同的條件將word文件顆粒化,,如分節(jié)符,、頁眉、頁腳、頁碼范圍和自定義頁碼等 PDF轉(zhuǎn)換:WORD轉(zhuǎn)PDF,,自動判斷是否生成書簽,,自動鑲嵌所有字體,生成PDF快速網(wǎng)頁瀏覽的PDF,,確保生成的PDF所有屬性符合法規(guī)要求 文檔驗證:驗證文檔的字體,、字號、紙張,、頁面布局,、空白頁、頁碼,、編號,、目錄、超鏈接等,,并且可以定位驗證結(jié)果 可定制:可根據(jù)用戶需求定制格式和樣式模板北京DMFeCTD