山東仿制藥eCTD服務價格
歐洲藥品管理局:集中審評程序由歐洲藥品管理局(European Medicines Agency, EMA)負責協(xié)調。 人用藥品委員會:人用藥品委員會(Committee for Medicinal Products for Human Use, CHMP)負責提供科學意見,。 歐盟委員會:CHMP的意見隨后被提交給歐盟委員會(European Commission, EC),,由歐盟委員會做出是否授權的終決定,。這個決定在整個歐盟都是具有法律約束力的,。 審批過程: 申請人向EMA提交申請,包括eCTD(電子通用技術文檔)格式的藥品注冊文檔,。 EMA的CHMP分配一個科學評估團隊(Rapporteur和Co-Rapporteur),負責初步評估,。 CHMP基于評估團隊的報告提供科學意見。 歐盟委員會根據CHMP的意見做出終決定,,批準或拒絕藥品上市。 授權范圍 如果藥品獲得批準,,將獲得在整個歐盟、冰島,、列支敦士登和挪威有效的上市許可(Central Marketing Authorisation, CMA)。eCTD申報相關技術支持,。山東仿制藥eCTD服務價格
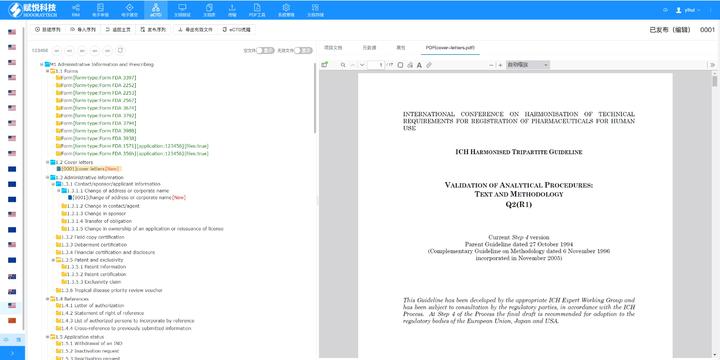
賦悅Word插件 自主研發(fā)Word插件 快速編輯:整合word常用功能按鈕,避免頻繁切換菜單,;內置標題、段落,、文字,、目錄,、超鏈接等的格式和樣式,可快速設置和更文檔的格式 快速鏈接:雙擊或者拖拽的方式,,制作文本超鏈接或者題注超鏈接;可搜索全文關鍵字,,自動制作超鏈接 文檔拆分:可根據不同的條件將word文件顆粒化,,如分節(jié)符,、頁眉,、頁腳,、頁碼范圍和自定義頁碼等 PDF轉換:WORD轉PDF,,自動判斷是否生成書簽,自動鑲嵌所有字體,,生成PDF快速網頁瀏覽的PDF,,確保生成的PDF所有屬性符合法規(guī)要求 文檔驗證:驗證文檔的字體、字號,、紙張,、頁面布局、空白頁,、頁碼,、編號、目錄,、超鏈接等,,并且可以定位驗證結果 可定制:可根據用戶需求定制格式和樣式模板INDeCTD服務放心可靠eCTD申報軟件相關技術支持,。

緊急申報與特殊通道:FDA設置緊急申報通道(如Pre-EUA和EUA),允許在公共衛(wèi)生事件中快速提交資料,。此類申請需在模塊1.19注明特殊標識,,并通過ESG加急處理。 eCTD版本兼容性與過渡策略:eCTD 4.0支持向前兼容,,允許v3.2.2文件無縫過渡,。企業(yè)需在2024年前完成系統(tǒng)升級,確保XML到HL7 RPS的格式轉換,。過渡期間需同時維護舊版本系統(tǒng)。 區(qū)域差異與全球化協(xié)調:美國模塊1要求嚴格,,如UUID標識符和組合申請支持,,而歐盟側重文件引用合規(guī)性,。FDA與PMDA、EMA通過ICH框架協(xié)調eCTD標準,,但區(qū)域特殊性仍需針對性適配,。 行業(yè)影響與長期價值:eCTD不是技術升級,更是全球藥品監(jiān)管一體化的驅動力,。其標準化、可追溯性和效率提升,,推動了跨國多中心試驗的協(xié)同申報,,加速創(chuàng)藥上市進程。
危機應對與應急遞交機制 在公共衛(wèi)生緊急事件(如COVID-19)中,,EMA允許簡化eCTD序列,優(yōu)先審評關鍵模塊并暫緩非數據,。申請人可通過快速通道(Fast Track)提交疫苗或藥物的eCTD資料,,審評周期可壓縮至6個月。此類申請需附風險評估報告,,并承諾后續(xù)補交完整數據,。 數據安全與長期存檔 歐盟要求eCTD資料存檔期限至少為藥品上市后30年,EMA采用分布式存儲和區(qū)塊鏈技術確保數據不可篡改,。申請人需定期備份本地副本,并使用符合GDPR要求的加密傳輸協(xié)議(如AS2)遞交,。歷史數據的遷移和格式轉換(如NeeS轉eCTD)需遵循特定技術規(guī)范。 環(huán)保效益與可持續(xù)發(fā)展 eCTD取代紙質遞交后,,歐盟每年減少約500噸紙張消耗,審評流程的數字化降低碳足跡約30%,。虛擬審評會議和電子簽名進一步減少了差旅需求,契合歐盟2050碳中和目標,。未來,,eCTD4.0將通過數據壓縮技術進一步降低服務器能耗。美國eCTD注冊外包相關技術支持,。

仿制藥作為提高藥物可及性與可負擔性的一類藥物,,2012年以前,,注冊審評是不收取任何費用的,但當時仿制藥申請積壓嚴重,從申報到獲批需要3~5年的時間,。 美國國會于2012年頒布了仿制藥使用者費用修正案(Generic Drug User Fee Amendments, GDUFA),,該法律要求制藥行業(yè)支付一定的用戶費用,,以補充仿制藥申請的審評以及現場檢查的費用,減少仿制藥申請積壓,,縮短審評時間,增加基于風險的現場檢查等,,其目的是加快公眾獲得安全有效的仿制藥,并降低行業(yè)成本,。 GDUFA必須每五年重授權一次,,于2017年更(GDUFA II),于2022年更(GDUFA III),; 目前收費種類分為以下四種:ANDA審評費,、DMF審評費,在審評時一次性繳納,;項目費(Program fee)、設施費(Facility fee),,是上市后每年繳納一次。加拿大IND注冊申報相關技術支持,。楊浦區(qū)生物制品eCTD服務商
加拿大eCTD注冊咨詢相關技術支持。山東仿制藥eCTD服務價格
申報流程與要求 ?資料準備 ?內容要求:包括產品描述,、生產工藝(原材料來源、設備參數等),、質量控制標準(SOP,、穩(wěn)定性數據)、安全性與毒性研究等,。 ?格式規(guī)范: 采用CTD(通用技術文件)格式,,按模塊分章節(jié)(如模塊3為CMC數據)。 電子提交需符合eCTD標準(文件小于10GB通過ESG系統(tǒng)提交,,超過可選用CD-ROM)。 ?提交與注冊 ?預分配DMF號:需在提交前申請,,確保文件與編號綁定,。 ?授權書(LOA)?:需向引用DMF的制劑廠商提供授權信,明確可查閱的章節(jié),。 ?費用:Ⅱ類原料藥DMF需繳納年費(2024年約9,468美元)。 ?FDA審核流程 ?行政審評:2-3周內確認文件完整性,。 ?完整性審評(CA)?:針對Ⅱ類DMF,約60天,。 ?技術審評:在DMF被制劑申請(如ANDA、NDA)引用時啟動,,周期60-180天,。 ?結果反饋:FDA可能要求補充數據,,但DMF本身無“批準”狀態(tài),通過后可能收到“無進一步意見函”(No Further Comment Letter),。山東仿制藥eCTD服務價格
- 高新區(qū)中國eCTD歡迎選購 2025-05-14
- 靜安區(qū)生物制品eCTD使用 2025-05-14
- 蕪湖新藥eCTD是什么 2025-05-14
- 吳江區(qū)賦悅科技eCTD供應商 2025-05-14
- 南京生物制品eCTD注冊系統(tǒng) 2025-05-14
- 上海化學藥品eCTD格式 2025-05-09
- 南京電子申報eCTD哪個品牌好 2025-05-09
- 太倉NDAeCTD服務價格 2025-05-09
- 浦東新區(qū)原料藥eCTD文件如何制作 2025-04-26
- 南京新藥eCTD找哪家 2025-04-26
- 倉儲RFID智能貨架 2025-06-09
- 福建話筒升降器改造調節(jié) 2025-06-09
- 普陀區(qū)通保三級通信網絡安全防護測評 2025-06-09
- 蘇州現代化電話交換系統(tǒng)訂做價格 2025-06-09
- 廣西臺式電腦租賃定制價格 2025-06-09
- 北京無線RFID讀卡器報價 2025-06-09
- 細胞視覺集成商 2025-06-09
- 鼓樓區(qū)企業(yè)管理服務一體化 2025-06-09
- 珠海市WMS倉儲管理系統(tǒng)定制電話 2025-06-09
- 宜興購買熱塑性復合材料規(guī)格尺寸 2025-06-09