-
 杭州電子申報eCTD找哪家
杭州電子申報eCTD找哪家生命周期管理與變更遞交 eCTD支持全生命周期管理,申請人需通過序列更(Sequence)反映藥品變更信息。例如CEP證書的更需提交“變更說明表”,,對比已批準(zhǔn)和擬修改內(nèi)容,,并附修訂版技術(shù)文檔。重大變更(如生產(chǎn)工藝調(diào)整)可能觸發(fā)GMP現(xiàn)場檢查,EDQM將根據(jù)風(fēng)險評估決定是否啟動核查。 電子簽名與法律效力 歐盟接受符合《電子簽名法》的數(shù)字簽名,手寫簽名的掃描件需嵌入PDF并加密保護,。模塊1的申請表和承諾書必須包含有效簽名,且XML文件需通過MD5校驗確保完整性,。若使用第三方簽署工具,,需提前向監(jiān)管機構(gòu)報備并獲取技術(shù)認可。 中小企業(yè)支持與資源獲取 EMA和EDQM為中小企業(yè)提供eCTD實施指南,、驗證工...
2025-04-23標(biāo)簽: eCTD -
 中國澳門國際注冊eCTD
中國澳門國際注冊eCTD2015年發(fā)布《關(guān)于藥品醫(yī)療器械審評審批制度的意見》,,提出藥監(jiān)五大目標(biāo),將eCTD納入國家藥監(jiān)數(shù)字化戰(zhàn)略,。2017年,,中國加入ICH(國際人用藥品注冊技術(shù)協(xié)調(diào)會),成為全球第八個監(jiān)管機構(gòu)成員,,加速與國際標(biāo)準(zhǔn)接軌,。2018年,國家藥監(jiān)局(NMPA)完成eCTD文檔管理系統(tǒng)招標(biāo),,由上海寶信與德國LORENZ合作搭建技術(shù)平臺,,標(biāo)志著技術(shù)基礎(chǔ)設(shè)施的落地,。 ?規(guī)范制定與試點階段(2019-2023年)? 2019-2020年,,CDE(藥品審評中心)發(fā)布《eCTD技術(shù)規(guī)范》《驗證標(biāo)準(zhǔn)》等征求意見稿,,并組織兩輪企業(yè)測試。2021年,,NMPA明確化學(xué)藥1類,、5.1類及生物制品1類上市申請適用eCTD,。2022...
2025-04-23標(biāo)簽: eCTD -
 合肥國際注冊eCTD名稱
合肥國際注冊eCTD名稱FDA圍繞eCTD發(fā)布了10余項法規(guī)指南,,涵蓋格式要求、文件生命周期,、數(shù)據(jù)安全等細節(jié),,其中《ICH M2 EWG》作為綜合性技術(shù)文件,,成為企業(yè)申報的參考。eCTD的實施提升了審評效率,,通過標(biāo)準(zhǔn)化XML結(jié)構(gòu)和電子簽章技術(shù),,減少了紙質(zhì)遞交的物流與時間成本,同時支持全生命周期管理,,便于后續(xù)變更和補充資料的動態(tài)更,。 美國在eCTD實施中注重與ICH國際標(biāo)準(zhǔn)的兼容性,例如采用統(tǒng)一的CTD模塊化結(jié)構(gòu)和PDF技術(shù)規(guī)范,。然而,,其區(qū)域性要求(如信封信息中的Application ID、Submission Subtype)仍體現(xiàn)本土化特色,。這種“國際框架+本地適配”的模式,,既保障了跨國藥企的申報便利,又滿足了F...
2025-04-23標(biāo)簽: eCTD -
 太倉藥品注冊eCTD
太倉藥品注冊eCTD申報流程與要求 ?資料準(zhǔn)備 ?內(nèi)容要求:包括產(chǎn)品描述,、生產(chǎn)工藝(原材料來源,、設(shè)備參數(shù)等)、質(zhì)量控制標(biāo)準(zhǔn)(SOP,、穩(wěn)定性數(shù)據(jù)),、安全性與毒性研究等。 ?格式規(guī)范: 采用CTD(通用技術(shù)文件)格式,,按模塊分章節(jié)(如模塊3為CMC數(shù)據(jù)),。 電子提交需符合eCTD標(biāo)準(zhǔn)(文件小于10GB通過ESG系統(tǒng)提交,超過可選用CD-ROM),。 ?提交與注冊 ?預(yù)分配DMF號:需在提交前申請,,確保文件與編號綁定。 ?授權(quán)書(LOA)?:需向引用DMF的制劑廠商提供授權(quán)信,,明確可查閱的章節(jié),。 ?費用:Ⅱ類原料藥DMF需繳納年費(2024年約9,468美元)。 ?FDA審核流程 ?行政審評:2-3周內(nèi)確認文件完整性,。 ...
2025-04-23標(biāo)簽: eCTD -
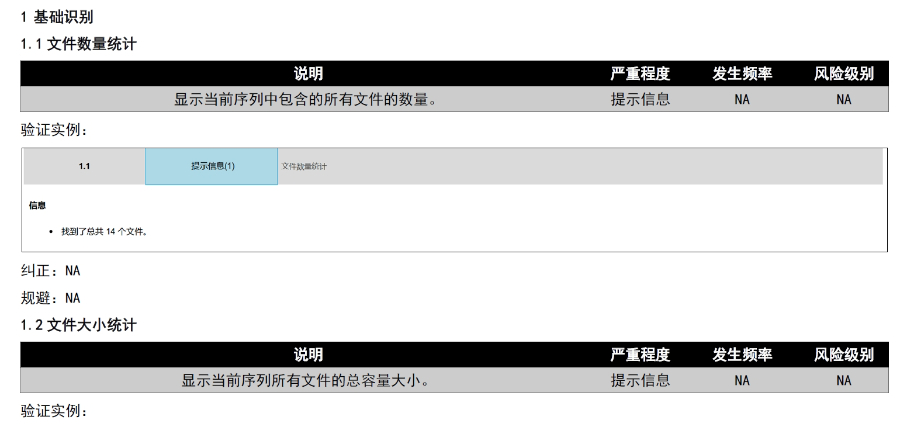 山東電子申報eCTD報價
山東電子申報eCTD報價DMF維護與合規(guī) ?年度更 即使無變更,,每年需提交聲明;重大工藝/設(shè)施變更需及時通知客戶并更文件,。 ?現(xiàn)場檢查 原料藥企業(yè)需通過FDA現(xiàn)場檢查,,驗證是否符合ICH Q7 GMP標(biāo)準(zhǔn),并與DMF內(nèi)容一致,。 ?轉(zhuǎn)讓與關(guān)閉 ?轉(zhuǎn)讓:需書面通知FDA并提供持有者信息,。 ?關(guān)閉:未提交年度報告或持有人主動申請,需說明原因并通知所有授權(quán)方。 關(guān)鍵注意事項 ?數(shù)據(jù)質(zhì)量:所有資料需準(zhǔn)確,、完整,,減少審核延遲風(fēng)險。 ?合規(guī)性:遵循FDA指南(如21 CFR Part 207)及USP標(biāo)準(zhǔn)(如培養(yǎng)基物料來源級別),。 ?溝通機制:建議通過專業(yè)機構(gòu)(如瑞歐佰藥)協(xié)助,,定期提交周報并制定計劃表以提高效率。 常見問題解答 ...
2025-04-23標(biāo)簽: eCTD -
 蕪湖仿制藥eCTD服務(wù)商
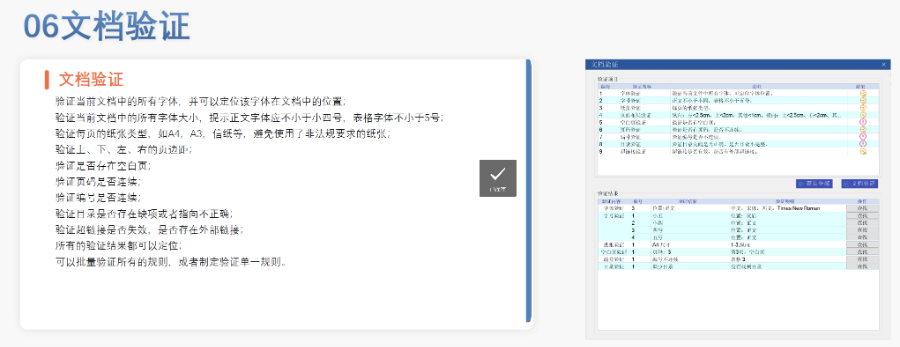
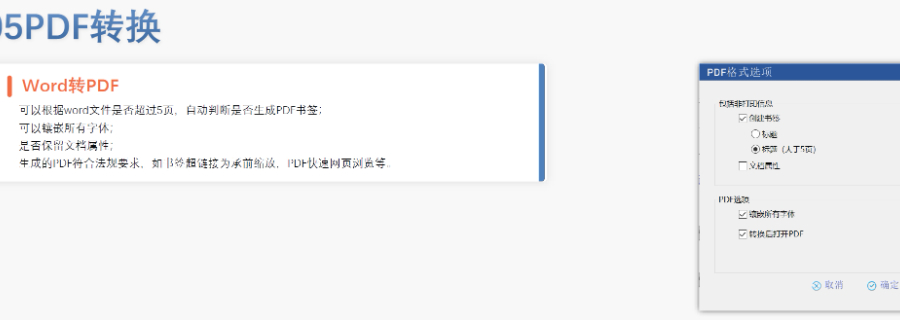
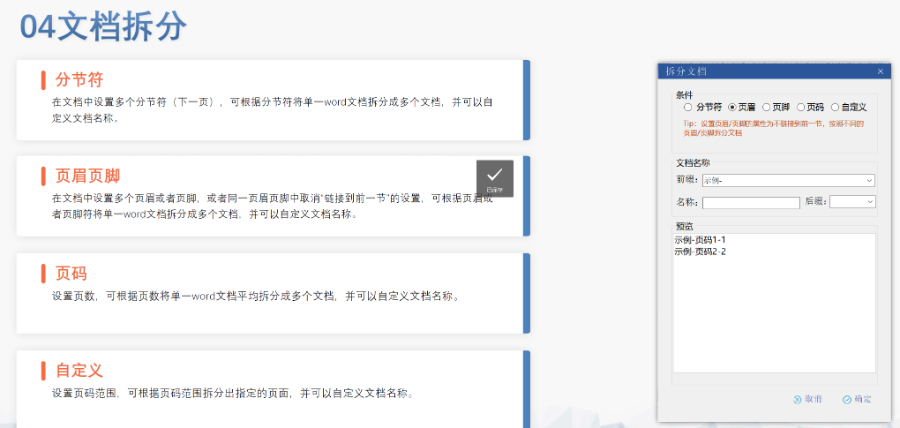
蕪湖仿制藥eCTD服務(wù)商賦悅Word插件 自主研發(fā)Word插件 快速編輯:整合word常用功能按鈕,,避免頻繁切換菜單,;內(nèi)置標(biāo)題、段落,、文字,、目錄、超鏈接等的格式和樣式,,可快速設(shè)置和更文檔的格式 快速鏈接:雙擊或者拖拽的方式,,制作文本超鏈接或者題注超鏈接;可搜索全文關(guān)鍵字,,自動制作超鏈接 文檔拆分:可根據(jù)不同的條件將word文件顆?;绶止?jié)符,、頁眉,、頁腳、頁碼范圍和自定義頁碼等 PDF轉(zhuǎn)換:WORD轉(zhuǎn)PDF,,自動判斷是否生成書簽,,自動鑲嵌所有字體,生成PDF快速網(wǎng)頁瀏覽的PDF,,確保生成的PDF所有屬性符合法規(guī)要求 文檔驗證:驗證文檔的字體,、字號、紙張,、頁面布局,、空白頁、頁碼,、編號,、目錄、超鏈接等,,并且可以定位驗證結(jié)...
2025-04-23標(biāo)簽: eCTD -
 ANDAeCTD常用解決方案
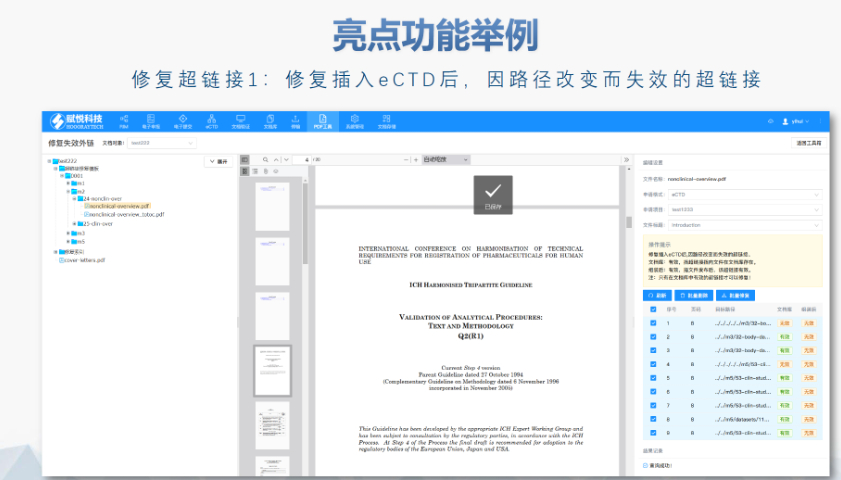
ANDAeCTD常用解決方案賦悅eCTD系統(tǒng) ?文件驗證與修復(fù) 支持自動驗證文件格式(如PDF屬性,、字體嵌入、超鏈接完整性等),,并一鍵修復(fù)不符合法規(guī)要求的文件,。例如,系統(tǒng)會自動檢查XML主干文件的結(jié)構(gòu)合規(guī)性,確保符合中國,、美國,、歐盟等地區(qū)的eCTD法規(guī)標(biāo)準(zhǔn),。 ?eCTD組裝與發(fā)布 可自動生成符合CTD結(jié)構(gòu)的電子文檔包,,包括XML主干文件、文件夾命名規(guī)范及序列號管理(如申請?zhí)?序列號文件夾自動生成),,并支持超鏈接和書簽的批量創(chuàng)建,。例如,初次提交的序列號為0000,,后續(xù)每次提交自動遞增,。 ?生命周期管理 支持文件全生命周期操作(增、增補,、替換,、刪除),并通過序列號疊加直觀顯示各章節(jié)文件的有效性,,覆蓋從初次提交到年報,、撤市的全...
2025-04-23標(biāo)簽: eCTD -
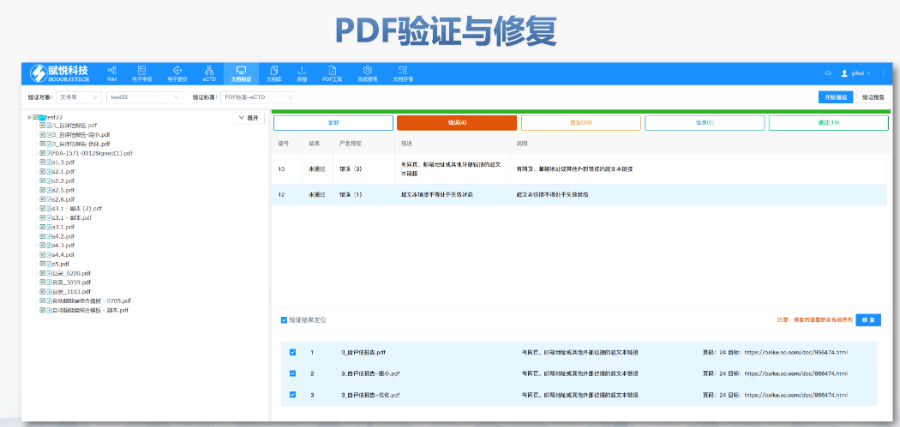 楊浦區(qū)ANDAeCTD發(fā)布軟件
楊浦區(qū)ANDAeCTD發(fā)布軟件內(nèi)容與格式檢查Word預(yù)處理:需檢查拼寫、縮略語,、單位格式(如),,設(shè)置多級列表自動編號(如),統(tǒng)一字體(宋體/TimesNewRoman)和段落格式,。重復(fù)內(nèi)容處理:相同劑型不同規(guī)格可共用模塊3,,但需區(qū)分包裝系統(tǒng)(如、),。外文資料:中文在前,、原文在后,參考文獻需中英文對照并建立跨網(wǎng)頁鏈接,。使用符合ICH標(biāo)準(zhǔn)的eCTD編輯器自動生成XML骨架和MD5校驗值,,拖拽PDF文件構(gòu)建結(jié)構(gòu)樹。序列管理:序列號從0000開始遞增,,每次提交需更新序列,,生命周期狀態(tài)(New/Replace/Delete)需在XML中明確標(biāo)注。驗證與遞交:確保無驗證錯誤(如書簽缺失,、超鏈接斷鏈),,通過ESG等電子通道傳...
2025-04-23標(biāo)簽: eCTD -
 靜安區(qū)ANDAeCTD業(yè)務(wù)
靜安區(qū)ANDAeCTD業(yè)務(wù)美國電子提交通道ESG(Electronic Submissions Gateway)是美國食品藥品監(jiān)督管理局(FDA)建立的電子化監(jiān)管信息提交系統(tǒng),旨在為制藥,、生物制品,、醫(yī)療器械等行業(yè)提供安全、高效的電子申報服務(wù)。自2006年啟用以來,,ESG已成為FDA接收電子監(jiān)管材料的入口,,每日處理上千份提交文件,涵蓋上市前審批,、上市后監(jiān)管,、臨床試驗數(shù)據(jù)、不良反應(yīng)報告等多種類型,。該系統(tǒng)通過數(shù)字證書加密和公鑰基礎(chǔ)設(shè)施(PKI)技術(shù),,確保文件傳輸?shù)恼鎸嵭浴⑼暾院筒豢煞裾J性,,符合FDA對電子提交的嚴(yán)格合規(guī)要求,。在技術(shù)層面,ESG具備強大的文件處理能力,。2018年系統(tǒng)升級后,,取消了單個文件8GB的限制,可支持高...
2025-04-23標(biāo)簽: eCTD -
 海南eCTD
海南eCTD設(shè)施費動態(tài)調(diào)整 API工廠和制劑工廠年費分別約6.8萬和14.5萬美元(2025財年),,CMO工廠費用為制劑費的24%,。國外工廠需額外支付1.5萬美元跨境檢查費。 ?繳費時限與懲罰 費用需在財年首日(10月1日)起20天內(nèi)繳納,,逾期將列入拖欠名單并暫停ANDA受理,,涉事藥品視為冒牌產(chǎn)品。 ?豁免與特殊情形 PET藥物,、非商業(yè)產(chǎn)品及停產(chǎn)超一年的工廠可豁免繳費,。已繳費工廠若年度內(nèi)無生產(chǎn)活動,仍需繳納費用,。 ?行業(yè)影響與策略 費用上漲推動企業(yè)優(yōu)化申報策略,,例如集中ANDA提交周期、采用CMO外包降低設(shè)施費,,并通過預(yù)認證(如DMF完整性評估)減少重復(fù)支出,。 澳大利亞eCTD注冊咨詢相關(guān)技術(shù)支持。海南e...
2025-04-23標(biāo)簽: eCTD -
 吳江區(qū)化學(xué)藥品eCTD系統(tǒng)
吳江區(qū)化學(xué)藥品eCTD系統(tǒng)此次eCTD實施范圍的擴大對外企而言影響,。實施范圍的擴大為外企提供了更多選擇,,特別是在產(chǎn)品線中NDA和AND占比相當(dāng)?shù)那闆r下。外企的系統(tǒng)和流程相對成熟,,因此它們對eCTD擴大范圍持積極態(tài)度,,更愿意嘗試和改變。盡管過程中可能遇到技術(shù)或法規(guī)上的問題,,但企業(yè)認為通過不斷反饋和與CDE溝通,,能夠幫助提高整體申報效率和質(zhì)量,。此外,外企還面臨向更集成化法規(guī)信息管理系統(tǒng)的挑戰(zhàn),,特別是當(dāng)需要遷移到系統(tǒng)時,。如果盡早將產(chǎn)品遷移到eCTD,無論是系統(tǒng)遷移還是后續(xù)的生命周期管理都會更加順暢,。 隨著eCTD實施范圍的擴大,,供應(yīng)商將擁有更多的業(yè)務(wù)機會。然而,,中國藥品注冊體系相對年輕化,,在推進eCTD實施過程中可能面臨各種...
2025-04-23標(biāo)簽: eCTD -
 廣東eCTD是什么
廣東eCTD是什么賦悅Word插件 自主研發(fā)Word插件 快速編輯:整合word常用功能按鈕,,避免頻繁切換菜單,;內(nèi)置標(biāo)題、段落,、文字,、目錄、超鏈接等的格式和樣式,,可快速設(shè)置和更文檔的格式 快速鏈接:雙擊或者拖拽的方式,,制作文本超鏈接或者題注超鏈接;可搜索全文關(guān)鍵字,,自動制作超鏈接 文檔拆分:可根據(jù)不同的條件將word文件顆?;绶止?jié)符,、頁眉,、頁腳、頁碼范圍和自定義頁碼等 PDF轉(zhuǎn)換:WORD轉(zhuǎn)PDF,,自動判斷是否生成書簽,,自動鑲嵌所有字體,生成PDF快速網(wǎng)頁瀏覽的PDF,,確保生成的PDF所有屬性符合法規(guī)要求 文檔驗證:驗證文檔的字體,、字號、紙張,、頁面布局,、空白頁、頁碼,、編號,、目錄、超鏈接等,,并且可以定位驗證結(jié)...
2025-04-22標(biāo)簽: eCTD -
 太倉藥品注冊eCTD便宜
太倉藥品注冊eCTD便宜技術(shù)壁壘與興市場挑戰(zhàn) 非洲和東南亞國家逐步采納eCTD,,但其IT基礎(chǔ)設(shè)施薄弱導(dǎo)致實施進度滯后,。歐盟通過“eCTD全球化倡議”提供技術(shù)援助,幫助興市場建立驗證體系和培訓(xùn)中心,??鐕幤笮栳槍Σ煌瑓^(qū)域定制遞交策略,例如在模塊1附加本地穩(wěn)定性數(shù)據(jù),。 監(jiān)管科學(xué)與創(chuàng)激勵 eCTD支持真實世界證據(jù)(RWE)和適應(yīng)性臨床試驗設(shè)計的整合,,加速創(chuàng)藥上市。EMA的PRIME計劃為突破性療法提供eCTD快速通道,,允許分階段提交模塊數(shù)據(jù),。孤兒藥和兒科藥的eCTD序列可享受費用減免和優(yōu)先審評。 供應(yīng)鏈安全與審計追蹤 eCTD的XML主干文件記錄所有提交版本,,支持供應(yīng)鏈問題的追溯分析,。原料藥CEP持有者需及時更變更信息,確...
2025-04-22標(biāo)簽: eCTD -
 江蘇中國eCTD常用解決方案
江蘇中國eCTD常用解決方案生命周期管理與變更遞交 eCTD支持全生命周期管理,,申請人需通過序列更(Sequence)反映藥品變更信息,。例如CEP證書的更需提交“變更說明表”,對比已批準(zhǔn)和擬修改內(nèi)容,,并附修訂版技術(shù)文檔,。重大變更(如生產(chǎn)工藝調(diào)整)可能觸發(fā)GMP現(xiàn)場檢查,EDQM將根據(jù)風(fēng)險評估決定是否啟動核查,。 電子簽名與法律效力 歐盟接受符合《電子簽名法》的數(shù)字簽名,,手寫簽名的掃描件需嵌入PDF并加密保護。模塊1的申請表和承諾書必須包含有效簽名,,且XML文件需通過MD5校驗確保完整性,。若使用第三方簽署工具,需提前向監(jiān)管機構(gòu)報備并獲取技術(shù)認可,。 中小企業(yè)支持與資源獲取 EMA和EDQM為中小企業(yè)提供eCTD實施指南,、驗證工...
2025-04-22標(biāo)簽: eCTD -
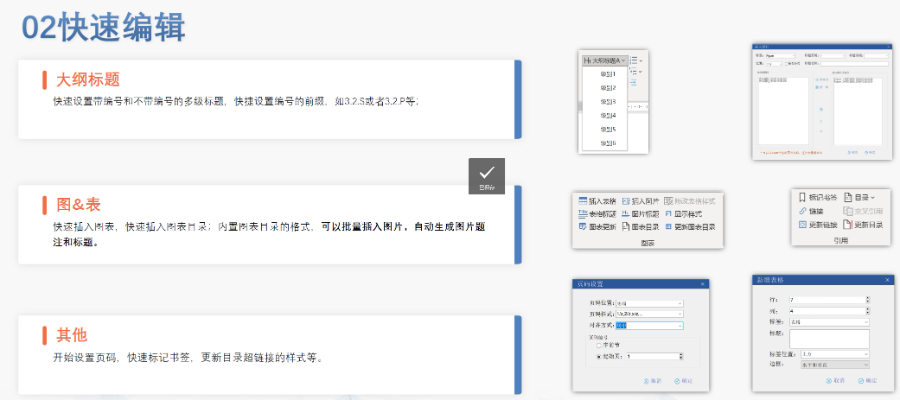 高新區(qū)原料藥eCTD醫(yī)療科技
高新區(qū)原料藥eCTD醫(yī)療科技賦悅Word插件 自主研發(fā)Word插件 快速編輯:整合word常用功能按鈕,避免頻繁切換菜單,;內(nèi)置標(biāo)題,、段落、文字,、目錄,、超鏈接等的格式和樣式,可快速設(shè)置和更文檔的格式 快速鏈接:雙擊或者拖拽的方式,,制作文本超鏈接或者題注超鏈接,;可搜索全文關(guān)鍵字,自動制作超鏈接 文檔拆分:可根據(jù)不同的條件將word文件顆?;?,如分節(jié)符,、頁眉、頁腳,、頁碼范圍和自定義頁碼等 PDF轉(zhuǎn)換:WORD轉(zhuǎn)PDF,,自動判斷是否生成書簽,自動鑲嵌所有字體,,生成PDF快速網(wǎng)頁瀏覽的PDF,,確保生成的PDF所有屬性符合法規(guī)要求 文檔驗證:驗證文檔的字體、字號,、紙張,、頁面布局、空白頁,、頁碼,、編號、目錄,、超鏈接等,,并且可以定位驗證結(jié)...
2025-04-22標(biāo)簽: eCTD -
 ANDAeCTD服務(wù)放心可靠
ANDAeCTD服務(wù)放心可靠歐美eCTD實施經(jīng)驗豐富,,中國可借鑒以加速進程,。中國可能會經(jīng)歷從企業(yè)自愿eCTD提交到強制eCTD提交的過渡,且將緊隨ICH步伐,,尤其在CMC資料整理方面,。全球正向eCTD 4.0過渡,中國也不例外,,將隨日本,、歐盟、美國等強制實施而逐步推進,。 中國崛起帶來全球化競爭機會,,eCTD實施將助力中國企業(yè)走向世界。技術(shù)進步將加速eCTD實施,,企業(yè)需密切關(guān)注技術(shù)動態(tài),,調(diào)整戰(zhàn)略。隨著國內(nèi)就業(yè)壓力增大和企業(yè)出海需求增加,,了解eCTD等國際標(biāo)準(zhǔn)將成為職業(yè)發(fā)展的重要競爭力,。 中國推進eCTD需面對特色問題,如上市后申請資料匹配,,需企業(yè)與監(jiān)管機構(gòu)共同解決,。基線要求是關(guān)鍵,,中國需制定適合國情的要求,。期待未來執(zhí)行指南...
2025-04-22標(biāo)簽: eCTD -
 浦東新區(qū)ANDAeCTD銷售電話
浦東新區(qū)ANDAeCTD銷售電話法規(guī)文檔管理系統(tǒng) 協(xié)同共享 RDMS可以讓跨區(qū)域,、跨部門協(xié)同真正成為1+1>2的 工作。讓頻繁的文檔共享傳輸,,版本管理,,生命周 期審批都變得輕松簡單 安全合規(guī) 通過詳細的審計追蹤、電子簽名,、權(quán)限管理,、網(wǎng) 關(guān)控制、頁面控制等技術(shù)手段,,構(gòu)建安全合規(guī)的 文檔管理系統(tǒng),,通過安全驗證與合規(guī)驗證 統(tǒng)一文檔來源 藥品注冊是企業(yè)經(jīng)營成果的技術(shù)資料,由多個部門 長時間匯集到法規(guī)部門,。RDMS確保多部門文檔來 源統(tǒng)一,,即使人員流動也可以快速接續(xù)工作 統(tǒng)一文檔結(jié)構(gòu) 根據(jù)不同申報類型,自動生成文檔結(jié)構(gòu),,讓法規(guī) 人員與跨部門同事掌握申報需要的資料需求,,降 低溝通成本,降低經(jīng)驗需求,,避免疏忽遺漏澳大利亞eCTD驗證標(biāo)準(zhǔn)相...
2025-04-22標(biāo)簽: eCTD -
 云南電子申報eCTD
云南電子申報eCTD美國于2003年成為全球早采用eCTD(電子通用技術(shù)文檔)的國家之一,,初由CDER和CBER作為電子提交平臺試點。2008年起,,eCTD正式成為藥申請(NDA)和生物制品許可申請(BLA)的標(biāo)準(zhǔn)格式,,并在2012年通過《藥申報者付費法案》(PDUFA)進一步強化其法律地位。至2017年,,F(xiàn)DA強制要求所有藥申請(NDA),、簡略藥申請(ANDA)及藥物主文件(DMF)必須采用eCTD格式提交,標(biāo)志著其從可選到強制的轉(zhuǎn)型,。這一進程在2018年擴展至臨床試驗申請(IND),,終實現(xiàn)全類型藥品注冊的電子化覆蓋加拿大eCTD申報軟件相關(guān)技術(shù)支持。云南電子申報eCTDANDA一般不需要提供臨床前(動物)和臨...
2025-04-22標(biāo)簽: eCTD -
 太倉化學(xué)藥品eCTD遞交
太倉化學(xué)藥品eCTD遞交eCTD在歐盟藥品監(jiān)管中的歷史背景:歐盟eCTD(電子通用技術(shù)文檔)的發(fā)展始于對臨床試驗和藥品審評流程標(biāo)準(zhǔn)化的需求,。2001年,,歐盟引入《臨床試驗指令》(CTD)作為統(tǒng)一的法律框架,但其分散的成員國申報機制導(dǎo)致效率低下,。2014年,,歐盟通過《臨床試驗法規(guī)》(CTR, Regulation EU No. 536/2014),要求通過CTIS平臺(臨床試驗信息系統(tǒng))集中提交臨床試驗申請(CTA),,并逐步推動eCTD作為電子化申報的工具,。這一旨在解決傳統(tǒng)CTD模式下審評周期長、多國協(xié)調(diào)成本高的問題,,為eCTD的實施奠定了基礎(chǔ),。美國API的DMF申報相關(guān)技術(shù)支持,。太倉化學(xué)藥品eCTD遞交申報流程與要求...
2025-04-22標(biāo)簽: eCTD -
 合肥國際注冊eCTD是什么
合肥國際注冊eCTD是什么仿制藥作為提高藥物可及性與可負擔(dān)性的一類藥物,2012年以前,,注冊審評是不收取任何費用的,,但當(dāng)時仿制藥申請積壓嚴(yán)重,從申報到獲批需要3~5年的時間,。 美國國會于2012年頒布了仿制藥使用者費用修正案(Generic Drug User Fee Amendments, GDUFA),,該法律要求制藥行業(yè)支付一定的用戶費用,以補充仿制藥申請的審評以及現(xiàn)場檢查的費用,,減少仿制藥申請積壓,,縮短審評時間,增加基于風(fēng)險的現(xiàn)場檢查等,,其目的是加快公眾獲得安全有效的仿制藥,,并降低行業(yè)成本。 GDUFA必須每五年重授權(quán)一次,,于2017年更(GDUFA II),,于2022年更(GDUFA III); 目前收費種類分...
2025-04-22標(biāo)簽: eCTD -
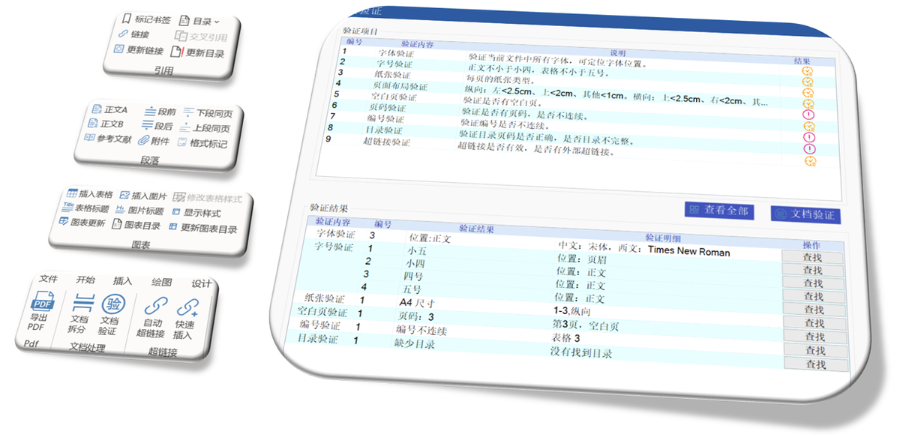 吳江區(qū)原料藥eCTD哪個品牌好
吳江區(qū)原料藥eCTD哪個品牌好GDUFA III框架與費用分類 2022年更的GDUFA III將費用分為ANDA申請費,、DMF認證費,、項目費及設(shè)施費四類,實施周期至2027年,。2025財年ANDA費用漲至約22萬美元,,較2024年增幅達27.5%,反映審評成本上升,。 ?ANDA申請費規(guī)則 費用需在提交時繳納,若申請被拒可退還75%,。重提交視為申請,,需再次繳費。關(guān)聯(lián)API的工廠數(shù)量影響總費用,,例如某ANDA引用3個API且涉及6家工廠,,需支付6倍DMF費用。 ?DMF費用機制 II類原料藥DMF需在引用前繳費,,一次性支付約5.3萬美元(2025財年),。未繳費DMF不得用于支持ANDA,否則觸發(fā)退審,。 ?項目費分級管理 根據(jù)...
2025-04-22標(biāo)簽: eCTD -
 寧波CDE eCTD找哪家
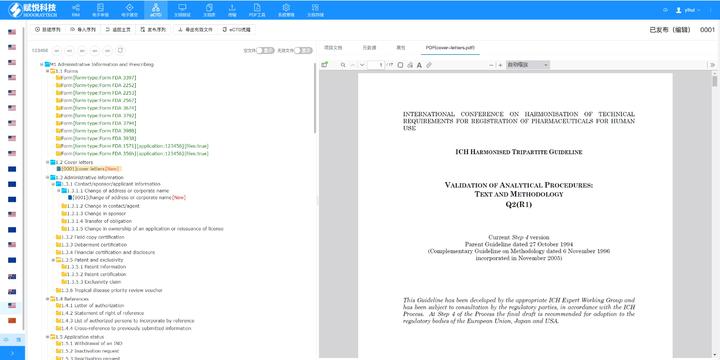
寧波CDE eCTD找哪家eCTD文件制作需遵循嚴(yán)格的法規(guī)要求和標(biāo)準(zhǔn)化流程,,以下是關(guān)鍵要點整理:eCTD采用模塊化結(jié)構(gòu),包含模塊1(行政信息)至模塊5(臨床報告),,需按ICH和監(jiān)機構(gòu)要求構(gòu)建目錄樹,。顆粒度選擇:文件提交層級需在***申報時確定并沿用,,例如原料和制劑的章節(jié)(如、)需按比較低顆粒度拆分,,輔料單獨成章,。PDF需添加書簽(導(dǎo)航目錄)和超鏈接(跨網(wǎng)頁跳轉(zhuǎn)),超過5頁的文件必須包含目錄(TOC/LOT/LOF),。技術(shù)參數(shù):初始視圖需設(shè)置默認縮放級別和頁面布局,,書簽展開層級不超過三級,單文件大小需符合申報系統(tǒng)限制,。驗證工具:使用軟件(如BXeCTD)自動生成書簽和超鏈接,,并通過序列校驗和PDF校驗功能確保...
2025-04-22標(biāo)簽: eCTD -
 安徽國產(chǎn)eCTD系統(tǒng)
安徽國產(chǎn)eCTD系統(tǒng)ANDA一般不需要提供臨床前(動物)和臨床(人體)數(shù)據(jù)來證明其安全性和有效性(即免毒理和臨床),作為替代,,申請人必須合理證明其產(chǎn)品與原研藥相比是生物等效的,。 按照《聯(lián)邦食品、藥品和化妝品法》第 505(j)章要求,,擬向FDA遞交申請ANDA的藥品需符合以下條件: 仿制藥必須依照FDA《經(jīng)過醫(yī)療等同性評價批準(zhǔn)的藥品》(俗稱"橙皮書")上所列,,由FDA選定的RLD/RS進行對照仿制; 活性成份、劑型,、規(guī)格,、給藥途徑、適應(yīng)癥,,要與RLD相同,; 仿制藥必須證明與RLD在生物效果上等同,即具有生物等效性,; 必須按照美國聯(lián)邦管理法21 CFR遵行藥品生產(chǎn)管理規(guī)范控制生產(chǎn)過程,; 無論中國還是美國,要求仿制藥...
2025-04-22標(biāo)簽: eCTD -
 吳江區(qū)CDE eCTD報價
吳江區(qū)CDE eCTD報價ANDA一般不需要提供臨床前(動物)和臨床(人體)數(shù)據(jù)來證明其安全性和有效性(即免毒理和臨床),,作為替代,,申請人必須合理證明其產(chǎn)品與原研藥相比是生物等效的。 按照《聯(lián)邦食品,、藥品和化妝品法》第 505(j)章要求,,擬向FDA遞交申請ANDA的藥品需符合以下條件: 仿制藥必須依照FDA《經(jīng)過醫(yī)療等同性評價批準(zhǔn)的藥品》(俗稱"橙皮書")上所列,由FDA選定的RLD/RS進行對照仿制; 活性成份,、劑型,、規(guī)格、給藥途徑,、適應(yīng)癥,,要與RLD相同; 仿制藥必須證明與RLD在生物效果上等同,即具有生物等效性,; 必須按照美國聯(lián)邦管理法21 CFR遵行藥品生產(chǎn)管理規(guī)范控制生產(chǎn)過程,; 無論中國還是美國,要求仿制藥...
2025-04-22標(biāo)簽: eCTD -
 閔行區(qū)藥品注冊eCTD哪個品牌好
閔行區(qū)藥品注冊eCTD哪個品牌好生命周期管理與變更遞交 eCTD支持全生命周期管理,,申請人需通過序列更(Sequence)反映藥品變更信息,。例如CEP證書的更需提交“變更說明表”,對比已批準(zhǔn)和擬修改內(nèi)容,,并附修訂版技術(shù)文檔,。重大變更(如生產(chǎn)工藝調(diào)整)可能觸發(fā)GMP現(xiàn)場檢查,EDQM將根據(jù)風(fēng)險評估決定是否啟動核查,。 電子簽名與法律效力 歐盟接受符合《電子簽名法》的數(shù)字簽名,,手寫簽名的掃描件需嵌入PDF并加密保護。模塊1的申請表和承諾書必須包含有效簽名,,且XML文件需通過MD5校驗確保完整性,。若使用第三方簽署工具,需提前向監(jiān)管機構(gòu)報備并獲取技術(shù)認可,。 中小企業(yè)支持與資源獲取 EMA和EDQM為中小企業(yè)提供eCTD實施指南,、驗證工...
2025-04-22標(biāo)簽: eCTD -
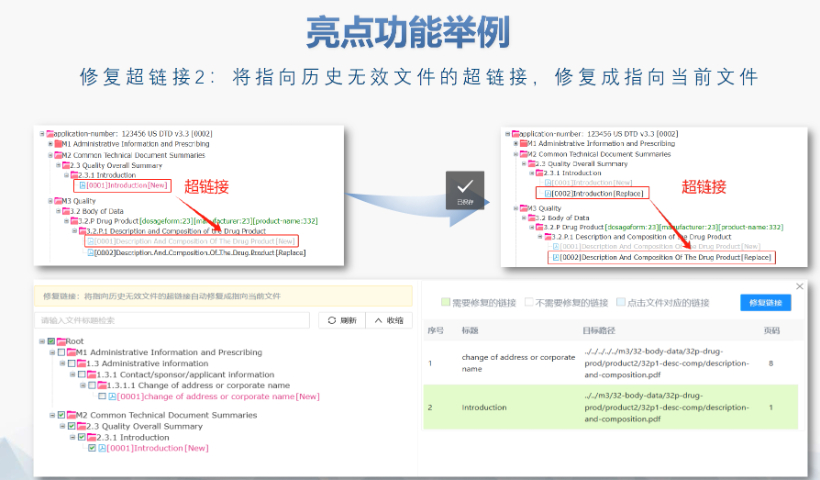 無錫國內(nèi)注冊eCTD發(fā)布軟件
無錫國內(nèi)注冊eCTD發(fā)布軟件eCTD的實施為監(jiān)管機構(gòu)和企業(yè)帶來了多重機遇,。電子化申報資料能夠極大地加速審評效率,,減少人為判斷錯誤和數(shù)據(jù)混淆的情況,從而提高審評的準(zhǔn)確性和速度,。同時,,eCTD帶來的數(shù)據(jù)標(biāo)準(zhǔn)化機遇使得全球監(jiān)管機構(gòu)的資料內(nèi)容和電子格式得以統(tǒng)一,有助于在不同監(jiān)管機構(gòu)之間進行數(shù)據(jù)傳輸和共享,。這對于提升全球監(jiān)管效率和行業(yè)研發(fā)效率具有重要意義,。 此外,eCTD的實施還促進了國際合作,,構(gòu)建了全球監(jiān)管的底層大數(shù)據(jù)基礎(chǔ),。對于企業(yè)而言,eCTD提供了一個規(guī)范化的研發(fā)活動模板,,有助于降低與監(jiān)管機構(gòu)溝通的成本,提高申報效率,。特別是對于國內(nèi)的生物技術(shù)企業(yè)而言,,eCTD的實施更是具有重要意義,有助于這些企業(yè)更好地走向國際市場,。然而,,中...
2025-04-22標(biāo)簽: eCTD -
 浦東新區(qū)仿制藥eCTD性價比
浦東新區(qū)仿制藥eCTD性價比eCTD的法規(guī)框架與技術(shù)規(guī)范:歐盟eCTD的法規(guī)層級包括指南(Guidelines)、指令(Directive)和法規(guī)(Regulation)。其中,,法規(guī)(如CTR)具有直接法律效力,,而指南(如ICH eCTD規(guī)范)則為技術(shù)操作提供參考。eCTD的結(jié)構(gòu)需符合歐盟模塊1規(guī)范(DTD 3.0+),,包含行政文件(模塊1)、質(zhì)量數(shù)據(jù)(模塊3)及臨床研究報告(模塊5)等內(nèi)容,,并通過XML文件實現(xiàn)數(shù)據(jù)互聯(lián),。例如,CEP(歐洲藥典適用性證書)的eCTD申報需單獨構(gòu)建信封(Envelope)和模塊1,,并指定標(biāo)識符(UUID)以確保技術(shù)合規(guī)性,。瑞士eCTD注冊外包相關(guān)技術(shù)支持。浦東新區(qū)仿制藥eCTD性價比審評效...
2025-04-22標(biāo)簽: eCTD -
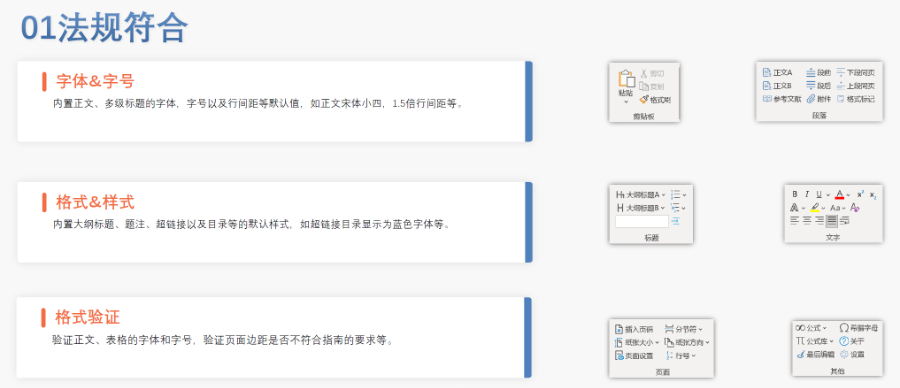 高新區(qū)CDE eCTD文件如何制作
高新區(qū)CDE eCTD文件如何制作危機應(yīng)對與應(yīng)急遞交機制 在公共衛(wèi)生緊急事件(如COVID-19)中,EMA允許簡化eCTD序列,,優(yōu)先審評關(guān)鍵模塊并暫緩非數(shù)據(jù)。申請人可通過快速通道(Fast Track)提交疫苗或藥物的eCTD資料,,審評周期可壓縮至6個月,。此類申請需附風(fēng)險評估報告,并承諾后續(xù)補交完整數(shù)據(jù),。 數(shù)據(jù)安全與長期存檔 歐盟要求eCTD資料存檔期限至少為藥品上市后30年,EMA采用分布式存儲和區(qū)塊鏈技術(shù)確保數(shù)據(jù)不可篡改,。申請人需定期備份本地副本,,并使用符合GDPR要求的加密傳輸協(xié)議(如AS2)遞交。歷史數(shù)據(jù)的遷移和格式轉(zhuǎn)換(如NeeS轉(zhuǎn)eCTD)需遵循特定技術(shù)規(guī)范,。 環(huán)保效益與可持續(xù)發(fā)展 eCTD取代紙質(zhì)遞交后,,歐盟每...
2025-04-21標(biāo)簽: eCTD -
 寧波仿制藥eCTD業(yè)務(wù)
寧波仿制藥eCTD業(yè)務(wù)ANDA遞交: 按照ICH M4的CTD格式整理資料,并以eCTD格式遞交,; 通過ESG通道遞交資料,; 收到CDER的letter,說明資料已經(jīng)進入FDA數(shù)據(jù)庫,; 付GDUFA費,,在資料遞交后的10日內(nèi)到賬; ANDA接收: 繳費后,,F(xiàn)DA初步審查資料的完整性,,并會在60天給答復(fù)。 第一種情況是ANDA無缺陷,F(xiàn)DA給申請人發(fā)受理信(Acceptance Letter),; 第二種情況是ANDA包含少于10個小缺陷,,F(xiàn)DA將會通過電話、傳真,、電子郵件等方式通知發(fā)布IR (信息請求函),,讓申請人在7個日歷日內(nèi)改正,,若未按時補充所有需要的資料,,F(xiàn)DA將拒收該ANDA; 第三種情況是ANDA包含1個或...
2025-04-21標(biāo)簽: eCTD -
 蕪湖NDAeCTD歡迎選購
蕪湖NDAeCTD歡迎選購設(shè)施費動態(tài)調(diào)整 API工廠和制劑工廠年費分別約6.8萬和14.5萬美元(2025財年),,CMO工廠費用為制劑費的24%,。國外工廠需額外支付1.5萬美元跨境檢查費。 ?繳費時限與懲罰 費用需在財年首日(10月1日)起20天內(nèi)繳納,,逾期將列入拖欠名單并暫停ANDA受理,,涉事藥品視為冒牌產(chǎn)品。 ?豁免與特殊情形 PET藥物,、非商業(yè)產(chǎn)品及停產(chǎn)超一年的工廠可豁免繳費,。已繳費工廠若年度內(nèi)無生產(chǎn)活動,仍需繳納費用,。 ?行業(yè)影響與策略 費用上漲推動企業(yè)優(yōu)化申報策略,,例如集中ANDA提交周期、采用CMO外包降低設(shè)施費,,并通過預(yù)認證(如DMF完整性評估)減少重復(fù)支出,。 瑞士IND注冊申報相關(guān)技術(shù)支持。蕪湖NDAe...
2025-04-21標(biāo)簽: eCTD